2023年1月16日,中國科學院生物物理研究所孫飛,季剛,朱赟作為共同通訊在《Nature Methods 》雜志在線發表了題為"ELI trifocal microscope: a precise system to prepare target cryo-lamellae for in situ cryo-ET study"的研究論文,介紹了由中國科學院生物物理研究所蛋白質科學研究平臺生物成像中心自主研發的三束(電子束Electron beam, 光束Light beam,離子束Ion beam)共焦熒光實時監控的聚焦離子束精準減薄系統--ELI-TriScope。ELI-TriScope系統在商用雙束掃描電子顯微鏡內部整合了一個基于冷凍樣品桿的傳輸系統(cryo-transfer system),以及一個內嵌的光學成像系統(cryogenic SimulTAneous monitoR system, cryo-STAR)。該系統在掃描電鏡的內部將電子束,光束和離子束同時聚焦在樣品臺上同一位置,實現了聚焦離子束減薄樣品的同時進行熒光實時監控成像。該系統通過監測目標分子的實時熒光信號,能夠精確且高效地制備包含目標結構的冷凍含水切片。借助ELI-TriScope,研究團隊以約91%的成功率從HeLa細胞中制備得到72片包含中心體的含水切片樣品,并通過隨后的冷凍電子斷層數據分析,發現了人體中心體新的原位結構特征。該研究結果證明,ELI-TriScope作為一種先進的、精確的、高效的冷凍聚焦離子束(cryo-FIB)減薄技術,在未來原位結構生物學研究體內特定事件的高分辨率超微結構領域具有極大應用潛力。

"眼見為實",細胞超微結構的三維可視化是理解生命的重要一步。隨著技術的快速發展,冷凍電子顯微鏡(cryo-EM)單顆粒分析技術已成為體外研究生物大分子三維高分辨率結構的重要工具之一。同時,冷凍電子斷層成像也迅速發展成為研究生物大分子復合物的原位高分辨率結構及其原位相互作用關系的關鍵技術。然而目前,冷凍電子斷層技術廣泛有效地應用于原位結構研究仍存在許多障礙,特別是在樣品制備方面,現有的冷凍樣品制備技術實驗效率低、定位精度低。冷凍聚焦離子束可以制備出表面平整的冷凍含水切片,被廣泛應用于原位結構生物學研究所需的高質量細胞冷凍含水切片的制備,并獲得了許多成功的應用。此外,為了實現聚焦離子束精準制備包含特定目標結構的冷凍含水切片樣品,冷凍光電關聯成像技術(cryo-CLEM)也應運而生。傳統的冷凍光電關聯成像工作流程需要一個獨立的冷凍熒光顯微鏡用于冷凍熒光成像,隨后再將樣品送入冷凍掃描電子顯微鏡(cryo-SEM)中,通過關聯對齊軟件將冷凍熒光圖像和冷凍掃描電鏡圖像之間進行關聯匹配,用于指導后續聚焦離子束減薄。由于該技術流程涉及冷凍樣品在多種顯微鏡之間的轉移,導致光電關聯成像操作復雜,且成功率較低。在該技術流程中,熒光標記目標物的三維空間位置是影響定位精度的關鍵因素,然而,這些信息只能通過寬場熒光成像或冷凍激光掃描共聚焦顯微成像(CACM)來大致確定,但受限于冷凍熒光顯微鏡的光學分辨能力,光電關聯對齊精度有限,難以實現精準定位胞內稀少、微小的目標結構。
最近幾年來,有研究提出將熒光成像系統集成到冷凍雙束掃描電鏡的真空腔室內,以避免樣品在不同設備間的多次轉移。商用的集成型光電關聯設備包括iFLM(賽默飛科學公司,美國)和METEOR (Delmic,荷蘭)。使用這些集成系統,可以在聚焦離子束減薄前后在掃描電鏡內部對冷凍樣品進行冷凍熒光成像,并完成關聯對齊,因不涉及樣品轉移,故有效減少了冰污染的風險。然而,由于嵌入冷凍掃描電鏡內的光學物鏡的數值孔徑(NA)較低,這些集成的光學成像分辨率普遍較低,從而影響后續圖像關聯精度,且該設備需要將樣品從冷凍熒光成像系統和冷凍FIB成像之間頻繁切換,大大影響了聚焦離子束對目標物的減薄效率。
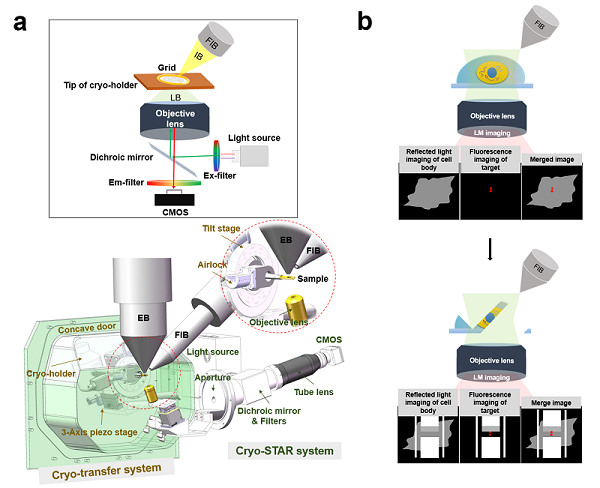
圖1.ELI-TriScope的設計原理。(a)ELI-TriScope的光路原理圖(上)及系統設計圖(下)。IB,離子束。LB,光束。EB,電子束。FIB,聚焦離子束。(b) ELI-TriScope的工作原理示意圖。離子束和光束同時聚焦在冷凍樣品中感興趣的區域,反射光成像(灰色)顯示細胞輪廓,熒光信號(紅色)用于實時監控cryo-FIB精準減薄。
為了解決上述技術難題,基于生物成像中心之前開發的基于高真空冷臺的光電關聯成像系統(High-vacuum Optical Platform for cryo-CLEM, HOPE)及其技術流程的研究基礎上,研究團隊基于雙束掃描電鏡(FEI Helios 600i)新研制了ELI-TriScope系統(圖1)。ELI-TriScope中集成了一個基于冷凍樣品桿的傳輸系統(cryo-transfer system),并在冷凍樣品下方嵌入了一個倒置熒光成像系統(cryo-STAR system)(圖1a),從而實現電子束(E)、光束(L)和離子束(I)被精確地聚焦到同一點上,經過對齊校準,通過監測目標分子真實的熒光信號,實現實時、精準地導航聚焦離子束減薄(圖1b)。使用ELI-TriScope,不需要添加熒光珠等基準標記,也避免了冷凍樣品在冷凍光鏡和冷凍掃描電子顯微鏡之間的傳輸以及圖像對齊,與其他冷凍光電關聯成像技術相比,ELI-TriScope有效提高了冷凍聚焦離子束減薄的效率、準確性、成功率和樣品制備通量。
隨后,研究團隊選擇人源細胞的中心粒作為原位結構研究的目標。在大多數情況下,每個細胞中僅存在一個中心體,即兩個中心粒。因此,對于哺乳動物細胞來說,在沒有熒光信號導航時,使用傳統的聚焦離子束減薄獲得含有中心粒的切片用于其原位結構研究是十分困難的。而ELI-TriScope的研發則解決了這一難題,通過熒光標記,ELI-TriScope成功制備了一批精準靶向中心體的冷凍含水切片樣品,對HeLa細胞內中心粒的捕獲成功率可達91%。
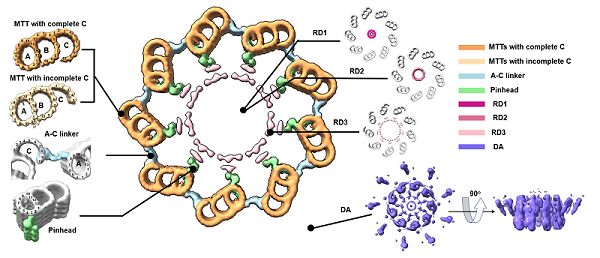
圖2. 人體中心粒的原位結構。中央大圖展示cryo-ET技術解析獲得的人中心粒橫截面圖。MTTs,微管三聯體;RD1-3,中心粒內部環狀密度;DA,遠端附屬結構。A-C linker,A管C管連接區。Pinhead,針頭狀結構。
隨后,研究團隊對制備出的72片包含中心粒的冷凍含水切片進行電子斷層數據收集及亞電子斷層平均處理(sub-tomogram averaging)。實驗結果(圖2)證實了人類中心粒中各種典型成分的超微結構,包括維持中心粒9重對稱性最重要的兩種微管三聯體結構(microtubule triblets,MTTs),即擁有完整C管的三聯管和不完整C管的三聯管;連接三聯管中A管與相鄰MTT中C管的A-C linker;連接A管與中心粒內部結構的pinhead等,這些結構的最高分辨率為2.5 nm。此外,研究人員通過手動挑選顆粒對中心粒內部結構進行了計算,發現其存在三種不同直徑的環狀密度結構(ring density,RD)。根據其直徑大小,這些結構分別命名為RD1、RD2、RD3。其中,RD3是此前在其它物種中心體相關研究中從未報道過的結構,其直徑在100 nm左右,由27個排列規則的點狀密度組成。在觀察到RD3的電子斷層重構體中,發現其與存在于中心粒遠端的附屬結構(distal appendages,DAs)與亞附屬結構(subdistal appendages,SDAs)總是同時出現,因此, RD3可能在維持中心粒遠端區域內部的凝聚力中起到重要作用。
綜上所述,ELI-TriScope為原位結構解析研究提供了一種非常成功的解決方案,將在未來的原位結構生物學中得到廣泛的應用。
中國科學院生物物理所孫飛研究員、季剛正高級工程師和朱赟研究員為本文的共同通訊作者,蛋白質科學研究平臺生物成像中心高級工程師李碩果、孫飛課題組博士生王子巖為該項工作的共同第一作者,生物成像中心賈星工程師在冷凍熒光樣品制備、牛彤欣工程師在數據處理、張建國高級工程師在冷凍傳輸裝置研制、工程師助理張小云在冷凍光鏡成像、孫飛課題組博士生殷國良在冷凍電鏡數據處理方面參與了該項研究。該研究獲得國家重點研發計劃、國家自然科學基金、中國科學院戰略性先導科技專項(B類)、中國科學院任務/知識創新工程重要方向項目的資助。樣品制備、數據收集和分析等工作受到生物物理所蛋白質科學研究平臺生物成像中心相關工作人員的大力支持和幫助。