01. 從傳統治療到精準治療的跨越

近年來,諾華的Lutathera®和Pluvicto®等藥物的成功獲批,大大加速了核藥的發展。諾華2024年的財報顯示Pluvicto®作為其中的重磅產品之一,2024年收入達到13.92億美元,同比增長42%,這是該藥自2022年上市以來,銷售額首次突破10億美元大關。與此同時,Lutathera®也表現不俗,2024年銷售額達到7.24億美元,同比增長20%。兩款核藥在2024年總收入達到21.16億美元,這一成績不僅展現了放射性配體治療診斷學在市場上的巨大潛力,更激發了全球科研者對新型放射性核素、靶向策略以及臨床應用的深入探索。在癌癥治療領域,放射性配體的診斷和治療學(Radioligand Theranostics)正以其獨特的精準性和創新性,引領著腫瘤治療的變革,它巧妙地將診斷成像與靶向放射性核素治療相結合,實現了從傳統“一刀切”式治療到精準狙擊腫瘤細胞的跨越。
2025年2月1日,MD安德森癌癥中心的H. Charles Manning教授為通訊作者于核醫學期刊《European Journal of Nuclear Medicine and Molecular Imaging》發表題為“Radiotheranostic landscape: A review of clinical and preclinical development”的綜述論文,深入剖析了核藥在臨床和臨床前研究中的最新進展,探討了這一領域在精準腫瘤治療中的巨大潛力以及面臨的挑戰。研究者不僅對截至2024年12月的全球活躍臨床試驗數據進行了系統梳理(數據來源:ClinicalTrials.gov和TheranosticTrials.org),還深入挖掘了近期的學術文獻,重點關注放射性核素生產、靶向分子和放射化學等領域的創新成果。小核僅做粗淺解讀,感興趣的讀者可以檢索原文仔細拜讀,深入了解核藥前沿領域的最新動態。

本綜述的通訊作者H. Charles Manning博士是德克薩斯大學MD安德森癌癥中心的教授,同時也是癌癥研究的CPRIT學者。他在2020年9月加入MD安德森癌癥中心,擔任先進生物醫學成像中心(CABI)的科學主任、回旋加速器放射化學設施(CRF)的主任,并共同領導Theranostics類的項目,其研究主要集中在用于癌癥的診斷和治療的新型放射性藥物的發現、轉化和生物學驗證。
02. 創新驅動核藥的蓬勃發展
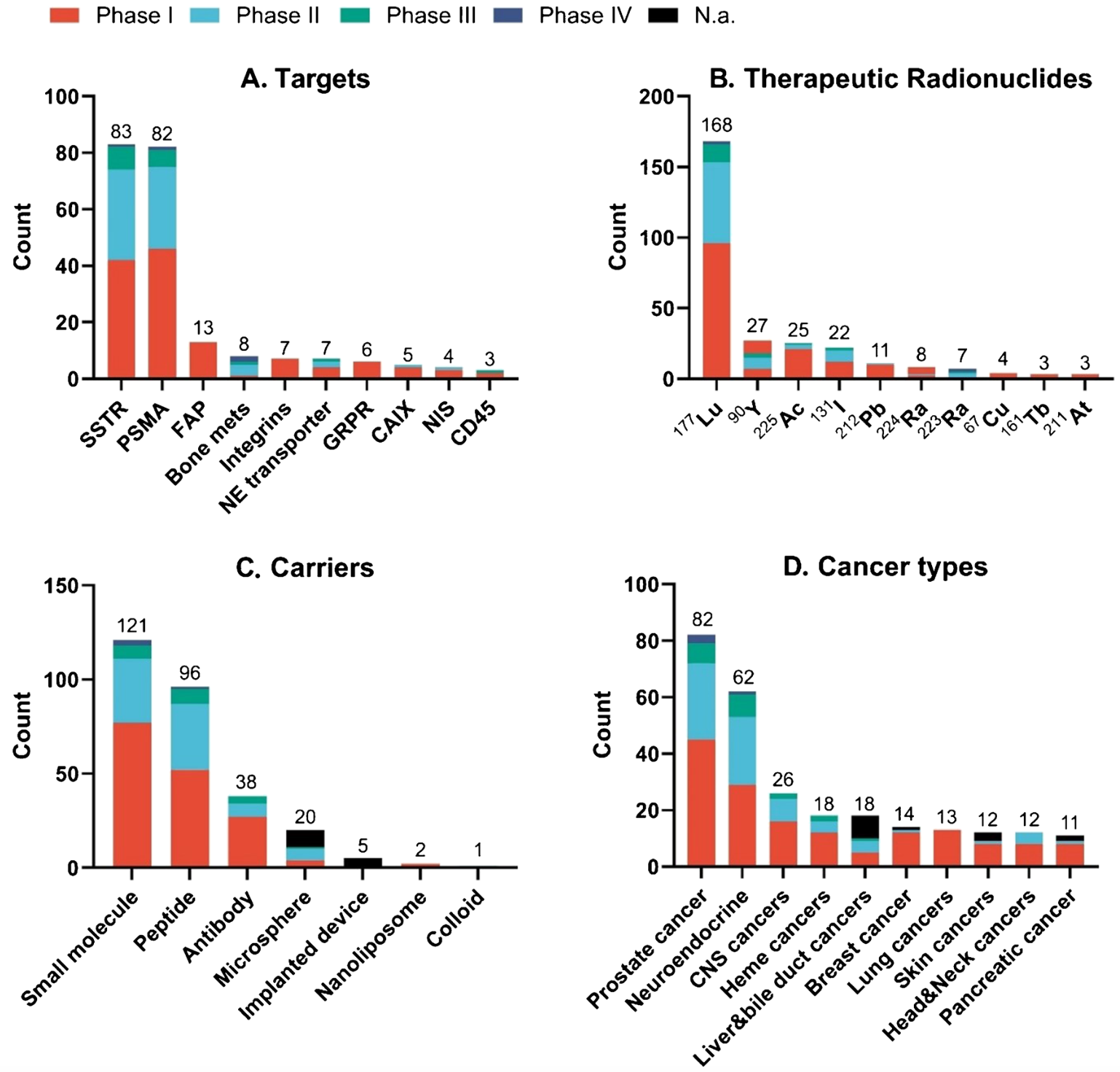
本圖展示了截至2024年12月正在進行的臨床試驗中,靶向放射治療藥物的評估情況。圖中包括了臨床試驗中涉及的前十大靶點(A)、治療性放射性核素(B)、核藥涉及載體類型(C)以及前十大癌癥類型(D)。圖中顯示,SSTR和PSMA仍然是最熱門的靶點;镥-177是最常用的治療性放射性核素。
在臨床研究方面,靶向生長抑素受體(SSTR)和前列腺特異性膜抗原(PSMA)的藥物一直是放射治療診斷學領域的“明星產品”。這些藥物憑借其明確的靶點和顯著的療效,在治療神經內分泌腫瘤和前列腺癌等疾病中發揮了重要作用。然而,隨著研究的不斷深入,越來越多的新靶點逐漸進入科研人員的視野。成纖維細胞激活蛋白(FAP)、整合素和胃泌素釋放肽受體(GRPR)等新靶點在臨床和臨床前研究中展現出巨大的潛力。這些新靶點的發現,不僅為放射治療診斷學的應用拓展了新的領域,也為那些傳統治療手段無效的癌癥患者帶來了新的希望。
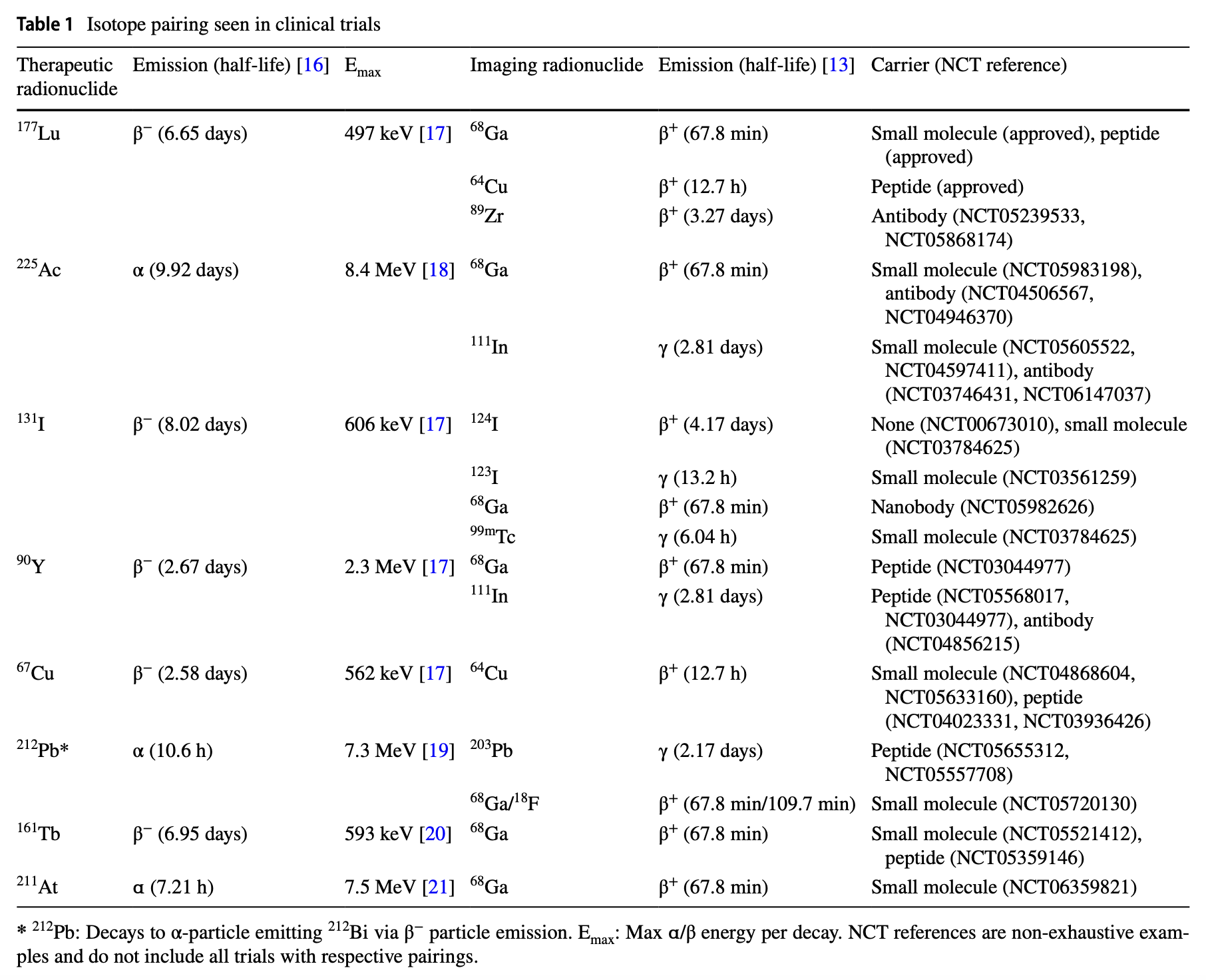
表1列出了在臨床試驗中使用的核素診療對情況,詳細列出了治療核素及其主要衰變模式、最大能量、用于成像的核素以及相關的臨床試驗編號。
在放射性核素載體方面,小分子和肽類一直是較為主流選擇。它們具有良好的生物相容性和易于合成的特點,能夠高效地將放射性核素輸送到腫瘤組織。然而,隨著對腫瘤生物學的深入了解,基于抗體的載體也逐漸嶄露頭角:雙特異性抗體、免疫球蛋白衍生的抗原結合片段和抗體模擬蛋白等新型載體,憑借其高度的特異性和適應性,能夠精準地識別腫瘤細胞表面的靶點,從而提高治療的精準度和效果。此外,放射性配體設計的創新也為放射治療診斷學的發展注入了新的活力,從激動劑到拮抗劑的轉變,以及具有增強藥代動力學和腫瘤靶向特性的修飾肽的開發,進一步優化了放射性藥物的性能。
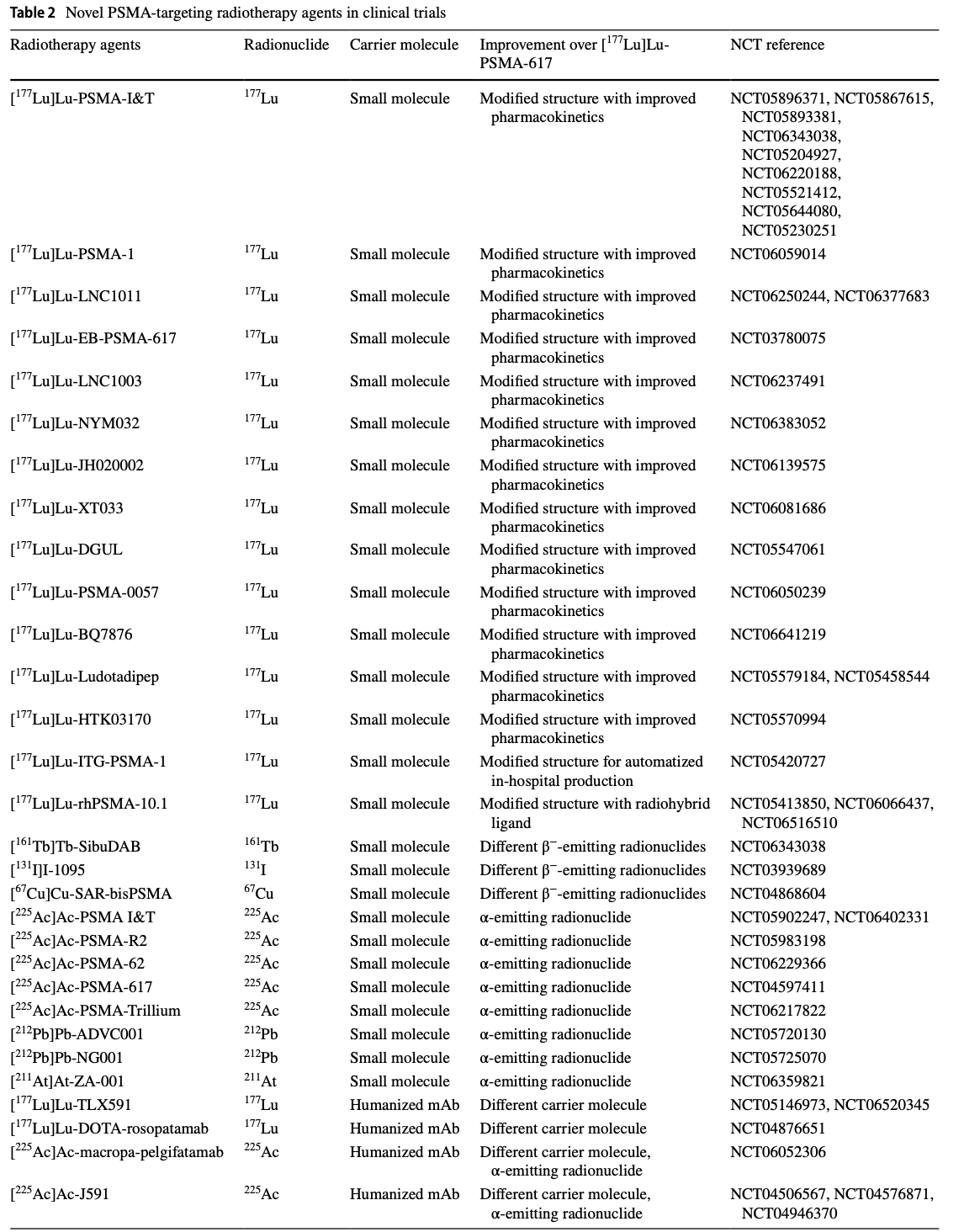
表2列出了新一代前列腺特異性膜抗原(PSMA)靶向放射治療藥物的詳細信息。表格中包括了藥物名稱、放射性核素、載體分子、與[177Lu]Lu-PSMA-617相比的改進之處,以及相關的臨床試驗編號(NCT)。這些新藥物通過改進結構、使用不同的放射性核素或載體分子,旨在提高藥物的藥代動力學特性、腫瘤靶向能力和治療效果。
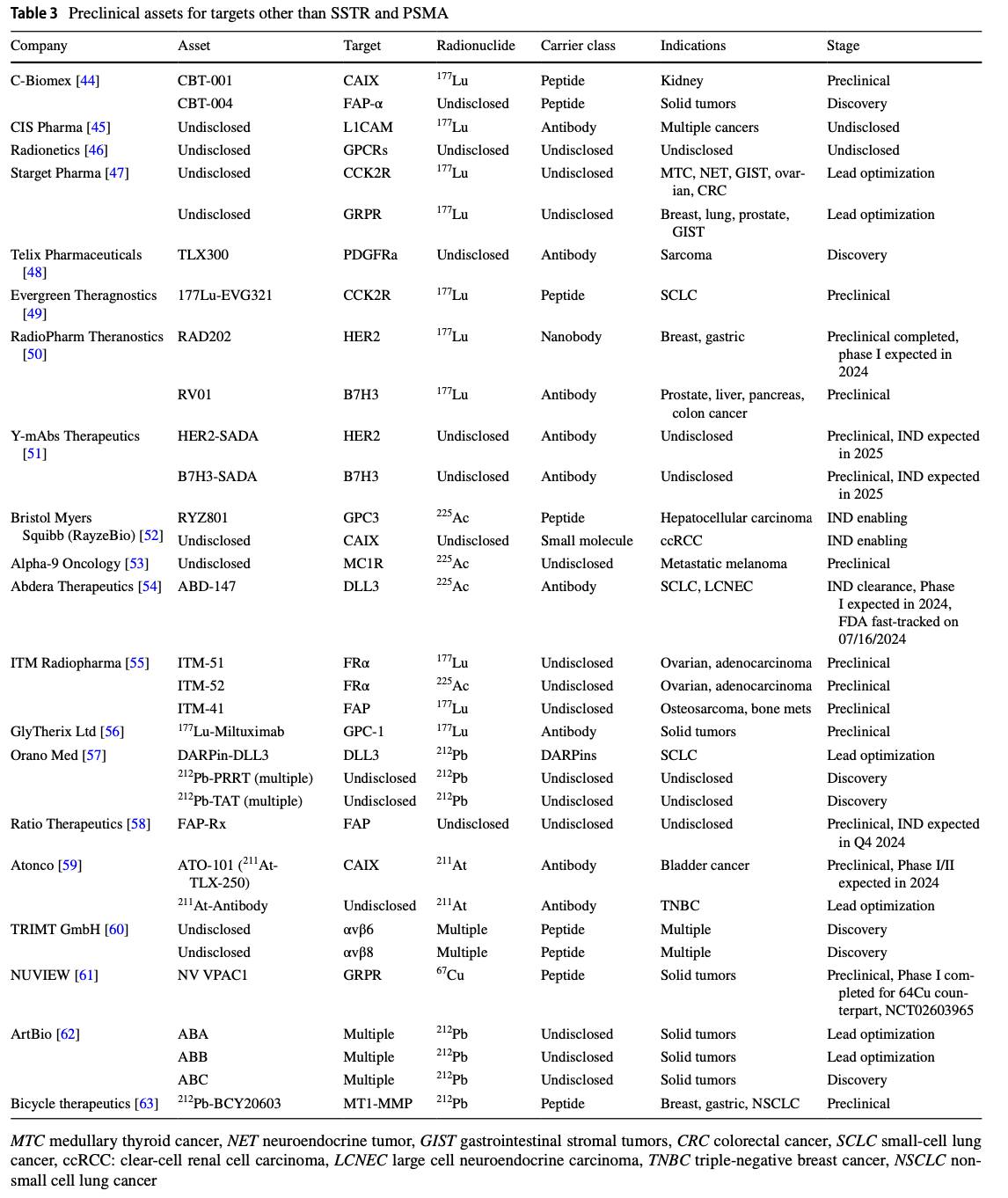
表3列出了目前處于臨床前研究階段的、非SSTR和PSMA靶點的放射治療藥物。表格中包括了公司名稱、藥物名稱、靶點、放射性核素、載體類別、適應癥以及研發階段。這些藥物涵蓋了多種新的靶點,如CAIX、FAP、GRPR等,展示了放射治療診斷學在不同癌癥類型中的潛在應用。
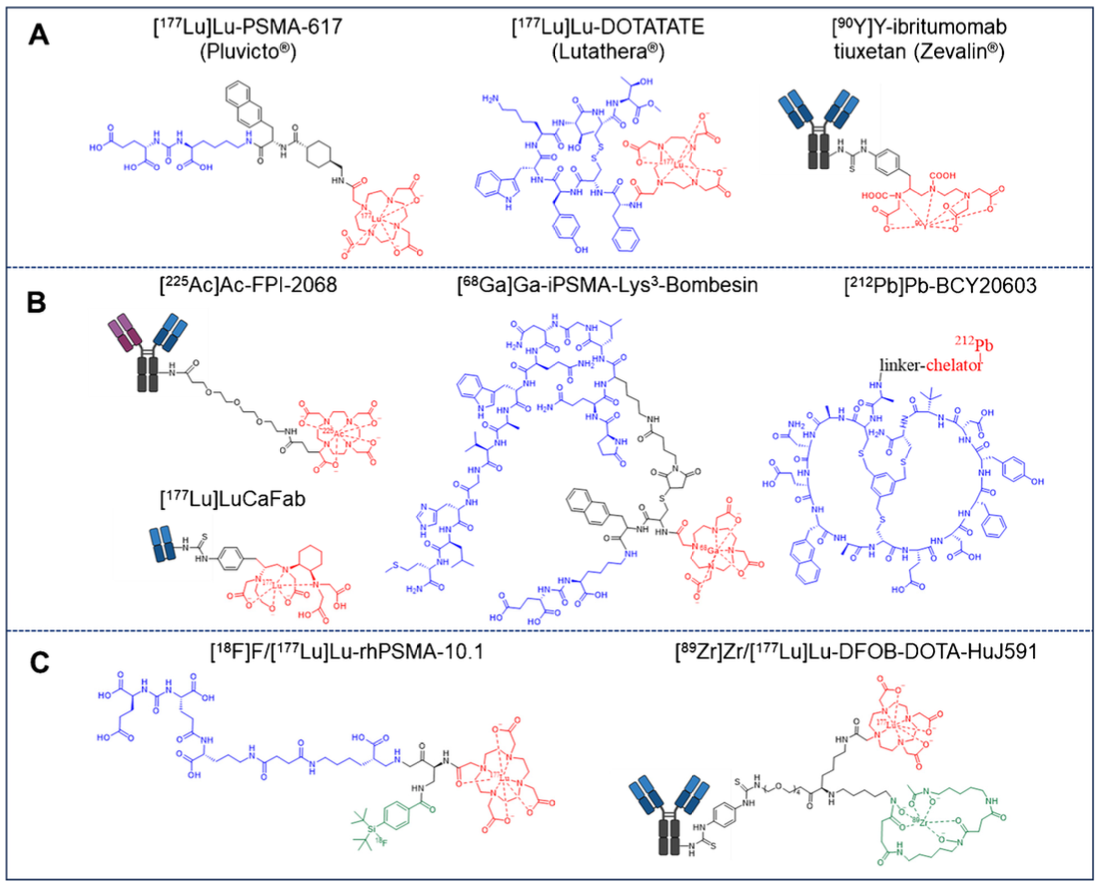
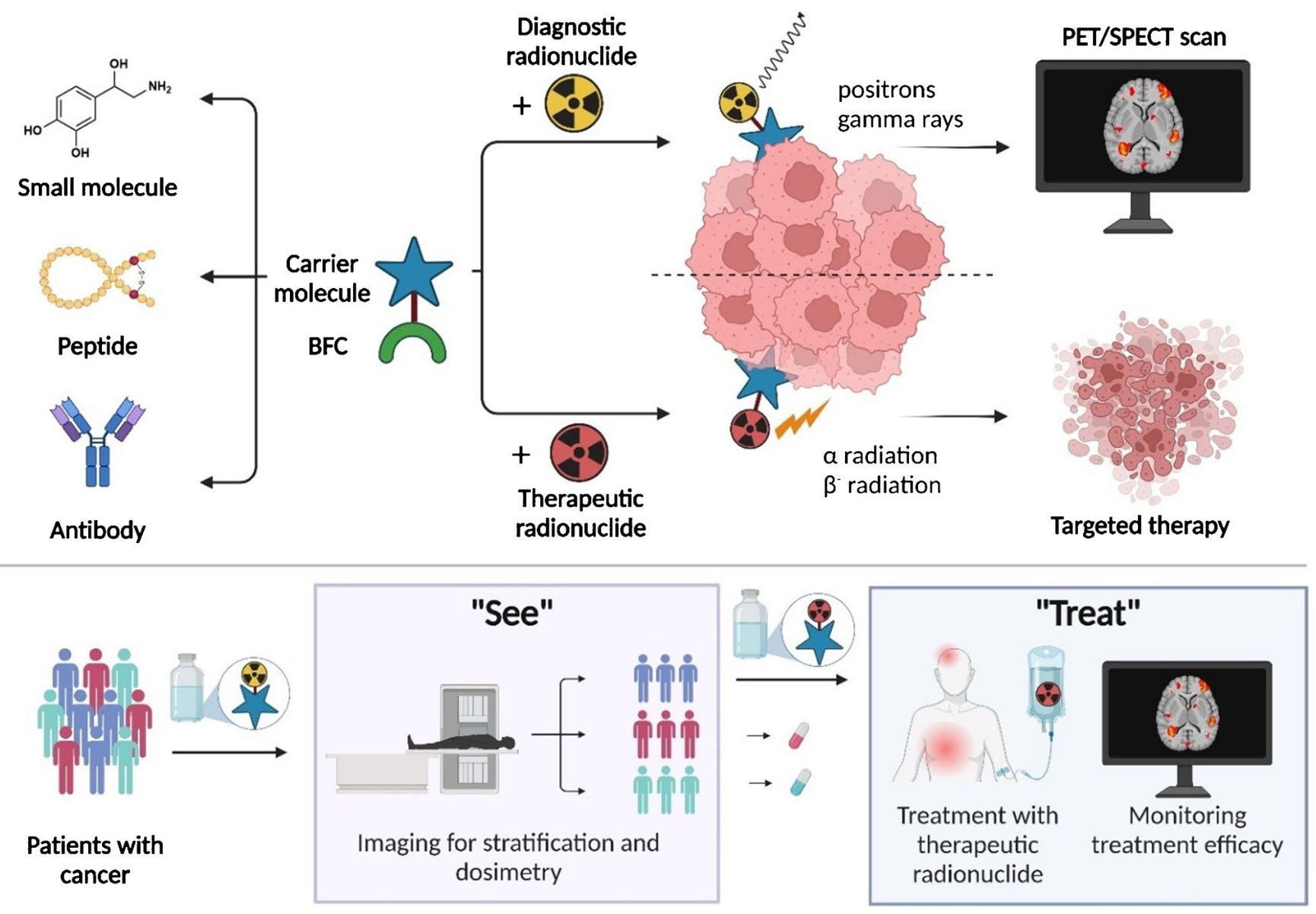
本圖展示了當前和新一代核藥的結構示例。
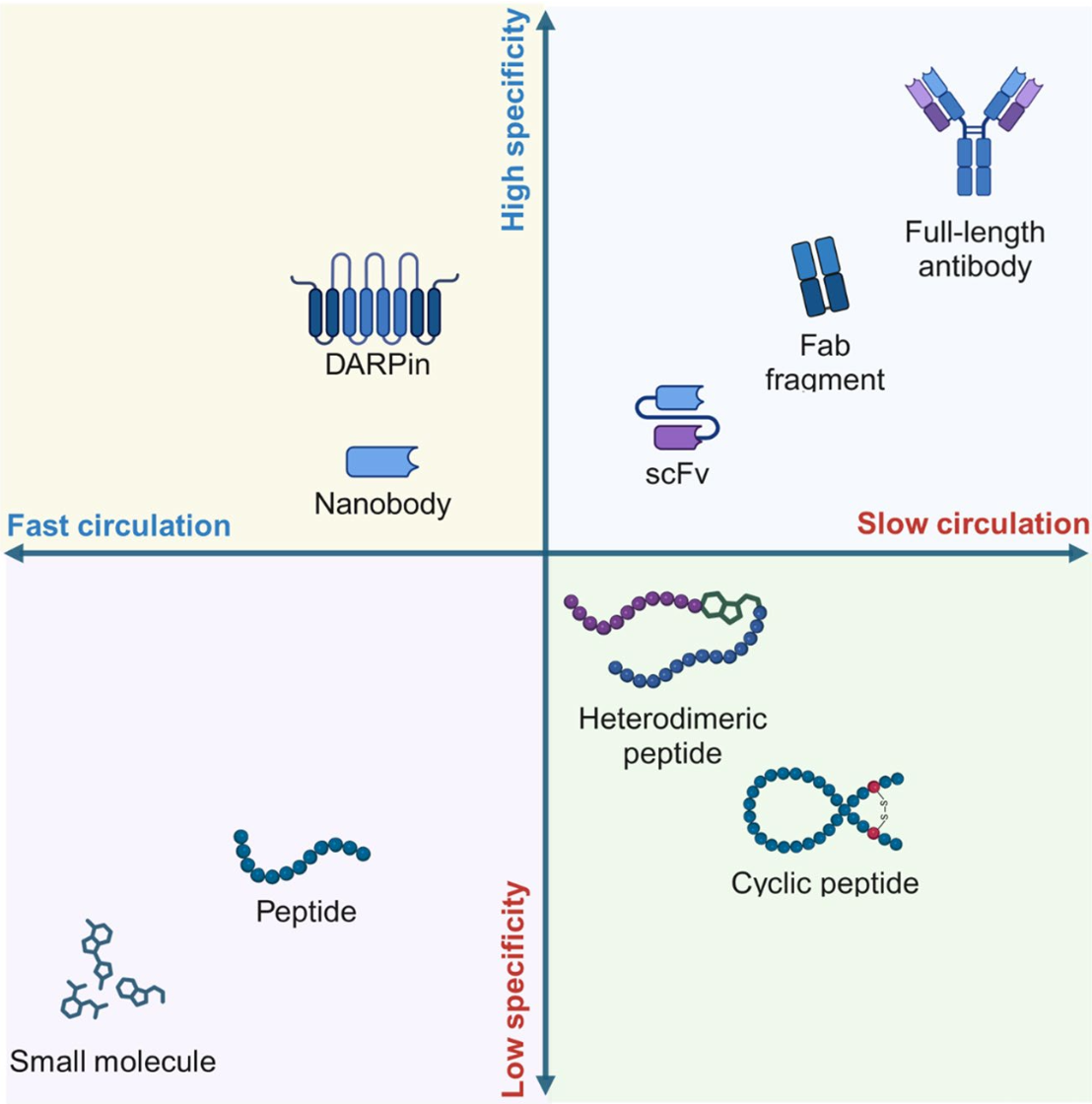
本圖總結了不同放射性核素載體(如抗體、抗體片段、小分子和肽類)的優勢和劣勢。抗體具有高特異性和長循環時間,但可能導致較高的非靶毒性;而小分子和肽類則具有更好的組織穿透性和細胞內化效率,但親和力較低且循環時間相對較短。
新一代治療性放射性核素的研究令人矚目,鋱-161、錒-225、鉛-212等新型放射性核素,正在被積極探索以補充或替代傳統的镥-177。這些新型放射性核素具有更高的能量和更優的物理特性,有望在提高療效的同時,進一步降低對正常組織的毒性。此外,配對的放射性核素和放射性雜化體系的出現,也為核藥的設計提供了更多的靈活性。配對核素能夠實現成像和治療的完美結合,優化治療劑量學,而放射性雜化體系則能夠在單個分子內螯合化學性質不同的放射性核素對,進一步拓展了放射治療診斷學的應用范圍。
03. 機遇與挑戰并存
盡管核藥正在以前所未有的速度革新精準醫療版圖,但要實現其全面臨床應用,仍需解決諸多“卡脖子”難題。首先,放射性核素供應鏈瓶頸問題較為突出。由于放射性核素的半衰期較短,其規模化生產不僅需要高度專業化的設備和技術,還需構建涵蓋生產、純化和質控的全鏈條技術體系。目前全球范圍內放射性核素的生產能力有限,難以滿足日益增長的臨床需求,供需矛盾持續加劇。其次,監管體系滯后于技術創新,現有的監管政策和技術標準尚不完善,這在一定程度上限制了核藥臨床應用的推廣,也是亟待解決的問題之一。此外,多學科交叉型人才儲備不足。核藥涉及核醫學、腫瘤學、放射化學和藥學等多個學科領域,需要具備跨學科知識的專業人才來推動其發展。然而目前全球范圍內相關專業人才的培養體系尚不健全,人才短缺問題也較為突出。
在這一充滿機遇與挑戰的時代,學術界、工業界和監管機構之間的協作或許比以往任何時候都更為重要。產學研醫管多方協同破局,可能會是釋放核藥真正潛力的關鍵所在,只有攜手共進,才能加速創新,優化臨床結果,讓核藥盡早惠及患者。