晏儂洋,是中國科學技術大學吳征威特任研究員團隊的一名碩士生。此前,晏儂洋的家人因為做手術結識了中南大學湘雅醫學院鄧幼文主任。家人做手術的經歷,催生了晏儂洋和導師吳征威的一個新選題,也促成了他們和鄧幼文團隊的合作。
通過這次合作,雙方設計出一種新型鈷離子復合材料,其具有抗生物膜、骨增強和巨噬細胞活性調節等作用。
首先,本次骨植入物可被用于提高骨科手術的成功率,加速患者的康復進程。
其次,通過等離子體技術賦予植入物抗菌特性,該植入物能夠作為減少術后感染風險的有效手段,為患者提供更安全的材料,降低因感染而造成額外治療的可能性。
再次,該材料能促進骨缺損修復。在骨缺損修復手術中,經過處理的材料能夠促進受損組織的再生和愈合,具有優異的生物相容性與理化性能,使其成為促進骨組織自然修復的理想選擇。
(來源:Advanced Science)
為防治骨科術感染提供新策略
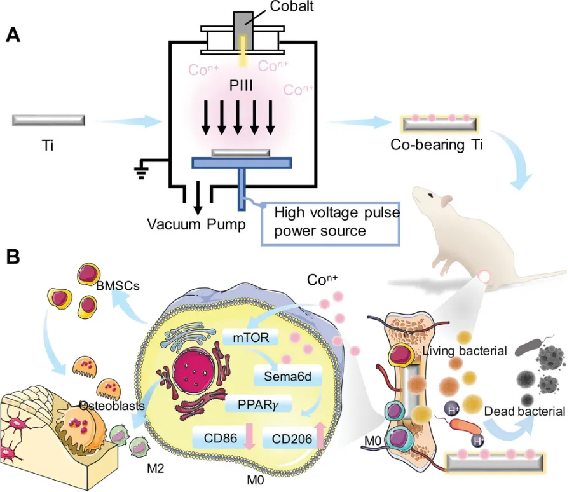
研究中,課題組利用等離子體浸沒離子注入技術,制備了這種含有鈷元素的鈦基骨植入物,并在生物學應用層面進行了探索。
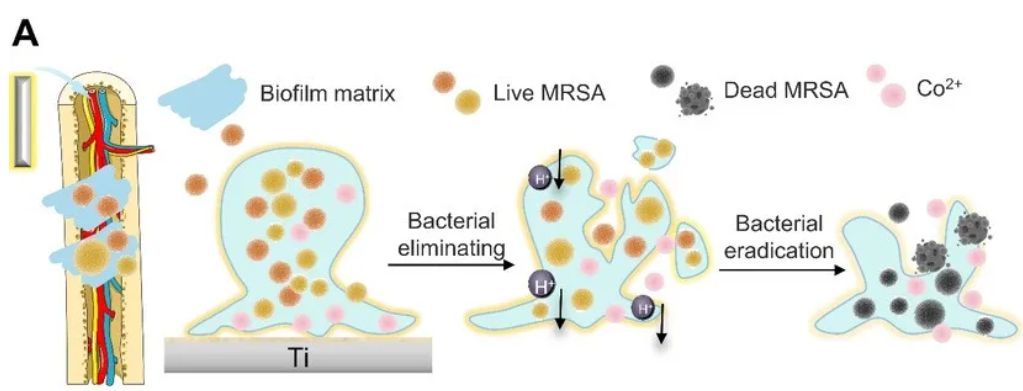
其發現,這種創新植入物在減少細菌粘附、消除感染以及加速骨修復方面展現出卓越的性能。
研究中,他們分析和解釋了鈷元素在促進骨修復和調節免疫反應中的重要作用。
從生物學角度來看,鈷元素的加入不僅促進了成骨細胞的分化,激活了與骨吸收和骨形成相關的多個信號通路,還有效抑制了破骨細胞的活性。這一發現對于理解含鈷材料與骨組織的相互作用至關重要。
這種材料還促使巨噬細胞轉變為 M2 型表型,這是一種與組織愈合和修復密切相關的免疫細胞狀態,能幫助營造有利于骨骼再生的免疫環境。
這種新的植入物能夠破壞細菌生物膜的形成,展現出顯著的抗菌活性。以耐甲氧西林金黃色葡萄球菌為例,其粘附率降低超過 80%。
綜合來看,本次研究在生物學層面為骨植入物的功能化和臨床應用提供了理論基礎和實踐指導,為預防和治療骨科手術后的感染提供了新策略。
同時,這項跨學科的研究成果,也為骨科植入物的發展開辟了新方向,有望在臨床應用中為患者帶來更好的治療效果。
(來源:Advanced Science)
從醫患關系到科研合作
如前所述,而本次研究的進行要從晏儂洋的故事說起,其家里有長輩進行了膝關節置換術后發生感染。她在回家探病期間與鄧幼文團隊聊起了感染性骨缺損發生的原因以及給患者帶來的痛苦。
這類患者不僅要承受身體上的巨大痛苦,還要面對漫長的康復過程和高昂的醫療費用。而細菌感染引發的炎癥反應,對于組織愈合過程存在顯著的阻礙。
傳統治療方法為避免感染,會長期使用抗生素,這通常會導致微生物耐藥性問題出現。
當時晏儂洋恰好通過等離子體殺滅環境空氣中微生物的成果獲得了中國研究生“雙碳”創新與創意大賽銀獎,于是她考慮是否可以使用等離子體解決臨床感染問題。
幾經嘗試后,其發現直接使用等離子體進行臨床處理有太多技術問題需要解決。因此決定換個思路——利用等離子體技術處理材料,給材料賦予新功能,提升材料抗菌、成骨、抗炎的性能。
閱讀大量文獻后,晏儂洋發現已有研究表明鈷離子具備上述能力,但效果會受到劑量影響,若劑量過大則會對人體產生負面影響。
基于此,晏儂洋等人決定采用等離子體浸沒離子注入技術來制備含鈷鈦合金骨植入物。借此發現這項技術能夠精確控制植入物的物理性質和化學性質,為患者提供更好的治療選擇。
浸沒式等離子體離子注入技術通過將材料暴露于等離子體環境中,并利用電場加速離子將其注入材料表面,從而賦予材料新功能。
該技術的優勢在于能夠精確控制離子的種類、劑量和注入深度,為材料表面改性提供了選擇性和精確度。
隨后,他們將鈦合金植入物置于等離子體設備中,并施加高壓脈沖,將鈷離子注入到鈦合金表面內。
這一過程涉及電流、電壓、氣壓、氣流、頻率、靶材等諸多需要調節的參數,每個參數的改變都對實驗結果有不同的影響,需要耐心進行數百次重復,直至找到最佳效果。
在這一過程中,晏儂洋家人與鄧幼文治療團隊之間的溝通也從醫患交流變成了學術交流。
晏儂洋表示:“湘雅三醫院團隊的加入是研究工作能夠完成不可或缺的一環。他們的臨床見解和技術支持,得以讓本次研究達到生物醫學的水準。”
與此同時,湘雅三醫院的博士生周豪進行了動物實驗,測試了植入物在模擬體內環境中的性能。
而課題組的目標是全面評估新制備的含鈷鈦合金骨植入物的關鍵性能,包括其生物物理適應性和抗菌活性。
這個過程不僅是對理論的驗證,更是對工藝和技術成功與否的考驗。基于此,他們首先關注植入物的生物物理適應性,即材料與骨組織的相容性。
在實驗室里,通過將植入物與細胞的共培養,記錄細胞在植入物表面的附著和生長情況。最初細胞生長效果總是不太好,以至于大家開始懷疑技術方案是否可行。
好在經過不斷的工藝調整,終于在某些特定參數下觀察到了促進細胞增長的現象,這一突破也讓大家知道自己正在接近目標。
在結果驗證階段,需要通過動物模型實驗來測試植入物的實際效果。他們選擇大鼠作為實驗動物模型,并為此特別定制了適用于大鼠骨結構的植入物樣品,再利用此前掌握的技術參數將鈷離子注入這批特制的樣品。
隨后在大鼠的股骨上制造了標準化的骨缺損,然后模擬臨床中骨修復的情況,從而將處理后植入物精確地放置在這些骨缺損處。為了模擬感染環境,其還在部分動物模型中引入了特定細菌,建立了感染性骨缺損模型。
實際效果的評價則包括了多個方面:
首先,他們定期對大鼠進行 X 光檢查,以監測新骨形成的情況。
其次,他們抽取大鼠的血液檢測其中的鈷離子含量,其中鈷離子含量并未出現浮動,這說明鈷離子的釋放并未擴散,安全性有保障。
最后,他們對大鼠進行了犧牲,并對骨整合區域進行組織學分析,評估骨組織的生長和修復情況。Micro-CT(微型計算機斷層掃描,Micro Computed Tomography)檢查顯示,植入物周圍的骨密度逐漸增加,表明新骨正在形成。
組織學分析也進一步證實了新骨組織的形成和成熟,以及植入物與宿主骨之間的緊密連接。
正面的實驗結果當然值得高興,同時也帶來了新的問題:是什么原因導致了新材料促進恢復的現象?
為此,他們開展了一系列分子生物學實驗,包括基因表達分析和蛋白質標記實驗,試圖揭示背后的分子機制。
后來,經過數周努力他們終于發現:幾個關鍵的信號通路在鈷離子的作用下會被激活,從而能夠促進成骨細胞的增殖和分化。
這一發現不僅提供了調控植入物生物物理適應性的理論基礎,也為材料設計提供了新方向。
最終,相關論文以《一種多功能含鈷植入物,通過巨噬細胞介導的免疫調節治療生物膜感染并促進感染性骨缺損的骨整合》(A Multifunctional Cobalt-Containing Implant for Treating Biofilm Infections and Promoting Osteointegration in Infected Bone Defects Through Macrophage-Mediated Immunomodulation)為題發在 Advanced Science[1]。
晏儂洋和周豪是共同一作,吳征威和鄧幼文擔任共同通訊作者。

圖 | 相關論文(來源:Advanced Science)
后續,他們將深化對這種材料的研究,通過更大規模的臨床試驗來驗證安全性和有效性,并將探索這種材料在生物醫學等其他領域的應用。
同時,他們也將考慮拓展研究方向:一方面將繼續優化等離子體處理材料后的間接生物效應,另一方面將探索等離子體直接作用于生物體的新可能性,希望能夠發現等離子體技術在促進組織生長、抗菌消炎和調節免疫等方面的新應用。