01研究背景
質子重離子束在組織中具有良好的物理和生物特性,在過去數年中,用于腫瘤治療的質子設備迅速增加。質子與其它放射治療技術相比的主要優勢是其在射程末端沉積了大劑量,即布拉格峰,而在其遠端無劑量。因此,定位質子束遠側邊緣的精度對于正確的劑量傳遞非常重要,即確保腫瘤的完全照射并減少對于危及器官的損傷。PET目前是臨床上唯一可用的3D、無創、體內監測質子束范圍的方法[2],因此在這一結合領域的研究迅速崛起。
采用PET對質子治療進行射程驗證尚有兩個挑戰:布拉格峰區域低能質子誘發的正電子湮滅輻射信號很低;照射后產生的正電子核素存在生物洗脫。此研究提出采用18O富集水(18-W)作為顯像劑的可能性:通過18-W代替常規水滲入活體組織,經質子束照射后產生正電子核素18F,進而行PET/CT成像和質子射程驗證。此研究假設18-W可以延緩正電子核素生物洗脫,在活細胞內質子束照射產生的18F將以氟陰離子(F-)的形式被捕獲,即使在照射后數小時也可以檢測到信號。02研究目的
評估18O富集水(18-W)是否可以將足夠的18O結合到活體中,從而在質子照射后產生可檢測的18F信號,并且探究照射后細胞內的放射性活度。
03材料與方法
1) 材料:采購商供的含70% 18O的18-W,并以1:9的比例與磷酸鹽緩沖液混合。采用頭頸部鱗癌細胞(T-HEp3)制備雞胚絨毛尿囊膜腫瘤模型。
2) 質子照射:采用相同質子束方案照射七個雞卵(用于體內分析的雞卵標記為E1–E3,用于體外分析的雞卵標記為T1–T4)。照射之前,在5分鐘內將200μL 18-W緩沖液局部滴加到腫瘤模型表面,以促進其在腫瘤內的吸收。使用機器人平臺和激光器將雞卵與質子束對準(圖1)。
其中6個雞卵(E1-E2,T1-T4)的平均射束強度為6.0±0.5nA。以約2.5*1013質子/cm2的累積通量照射腫瘤,使腫瘤中的總劑量(以100μm的厚度計算)達到2.4×105 Gy。使用相對較低強度的150pA質子束照射另一個卵(E3),傳遞127Gy的沉積劑量。此研究選擇比常規大的照射劑量是為了確保清晰地觀察樣品中的激活效應,并在較長的時間內測量衰變。
3) 活體PET/CT顯像:使用Micro PET/CT監測3個受照射后雞卵(E1和E2為高劑量照射,E3為低劑量照射)體內產生的放射性活度。低劑量(E3)照射的雞卵在照射后1小時進行10分鐘PET采集,高劑量(E1和E2)照射的雞卵在照射后3.5-4小時進行9小時PET采集,然后進行CT掃描。
E1和E2的PET數據分為9個連續的60分鐘/幀圖像進行重建, E3的PET數據重建為10分鐘/幀的單個圖像。使用3D-OSEM重建,矩陣為225×225×127,體素大小為0.554 mm×0.554mm×0.775 mm。在融合的PET/CT圖像上手動分割腫瘤體積,并分別獲得E1和E2的腫瘤放射性衰變曲線。然后在計算18F的物理衰變之后,將這些曲線進行指數擬合(考慮到生物洗脫)。
4) 體外分析:使用伽馬探測器記錄4個受照射雞卵(T1–T4)內產生的放射性活度,該探測器由CeBr3閃爍晶體組成,呈錐形(底部和頂部直徑分別為25和19 mm,高度為19 mm),并與光電倍增管(PMT)耦合。
在照射后10分鐘內,切除每個腫瘤,稱重,放置在0.5mL微量離心管中,并迅速離心。將離心管置于探測器內,采集29±5分鐘,記錄樣品的放射性活度。然后用PBS輕輕搖晃洗滌樣本5分鐘,并將腫瘤放入新試管中,快速離心,然后放回探測器。通過這種方式,細胞外基質中的放射性核素與可以通過細胞膜擴散的放射性核素將被洗脫,主要留下被截留在細胞內的放射性核素。另一次采集持續22±13分鐘,以確定洗滌后腫瘤中截留的放射性活度。
對探測器記錄的伽馬事件進行處理,獲得511keV峰值(±10%能量窗寬度)內放射性活度的衰減曲線,對衰變曲線(AMEA)進行指數擬合,包括11C、13N和18F的衰變,以獲得每個同位素的單獨貢獻。

圖1. 頂部圖:此研究的實驗方案示意圖。首先用18-W滴注雞卵,然后用8MeV的質子束照射雞卵,最后用伽瑪射線探測器對5個腫瘤進行體外分析,并用PET/CT掃描3個雞卵。底部圖:用外部質子束照射雞卵的實驗裝置圖。右圖中的白色圓圈描繪了腫瘤區域。04結果
1) 活體PET/CT顯像:使用PET/CT成像監測3個受照射雞卵體內的18F活度。在整個實驗期間,包括照射和PET/CT采集,雞胚保持存活。圖2a顯示了PET/CT融合圖像上輸送至E1的劑量分布估計。E1、E2和E3的PET/CT融合圖像如圖2b-d所示。E1和E2的PET圖像為第一個小時采集圖,E3的PET圖像為整個10分鐘采集圖。PET圖像顯示受照射腫瘤有高活性信號,而在雞卵的其余部分或雞胚中僅觀察到少量擴散活性。

圖2. (a) E1的輸送劑量、PET/CT融合圖像的疊加,圖中顯示了照射區域的放大圖像。照射后E1(b)、E2(c)及E3(d)的PET/CT融合圖像。
從E1和E2的9小時長動態PET圖像獲得的衰減曲線如圖3所示。對曲線進行指數擬合(考慮18F物理衰變和生物洗脫),擬合得出的E1和E2的組合半衰期分別為97.6±1.6min和101±8min,生物洗脫半衰期分別為14.7±2.2h和21±18h。一個重要的結果是:18F信號衰減主要由于物理衰變,在數小時內幾乎沒有觀察到生物洗脫,照射后8h 18F活性的生物洗脫低于32%。依據這些結果可以推斷:產生的18F離子大部分會滯留在腫瘤細胞內。
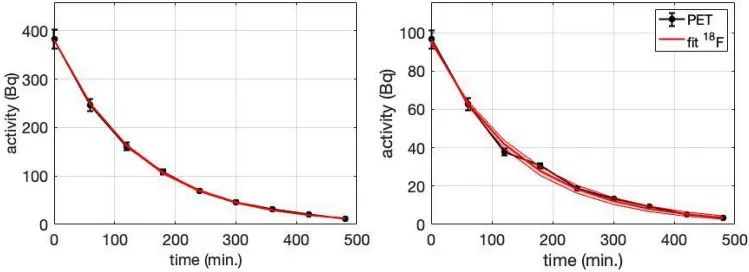
圖3. 動態PET圖像(黑色)和擬合(紅色)獲得的E1(左)和E2(右)的放射性活度衰減曲線。紅色陰影區域表示擬合的95%置信區間。
圖4顯示了遠離目標區域的一些18F活性。此活性對應于照射時細胞外空間(或血管)中存在的18-W。此18F在細胞膜外產生,并通過擴散或循環到達雞胚的其它區域。此外,一些18F聚集在雞胚的骨結構中,其實 18F-NaF是一種常用的放射性示蹤劑,用于監測成骨活性以檢測骨轉移。

圖4. E1的CT(左)和PET(右)最大密度投影圖。CT與PET圖像可見骨結構18F攝取(黃色箭頭顯示高攝取的下頜關節和無攝取的顱腔),以及腫瘤中的18F活性(白色箭頭)。
2) 體外分析:照射后切除4個受照射雞卵(T1-T4)的腫瘤,并用CeBr3探測器進行分析。圖5顯示了用γ探測器測量的腫瘤放射性活度衰變曲線,以及反映不同同位素貢獻的擬合曲線。在用PBS洗滌腫瘤之前,可以觀察到大量的18F產生。
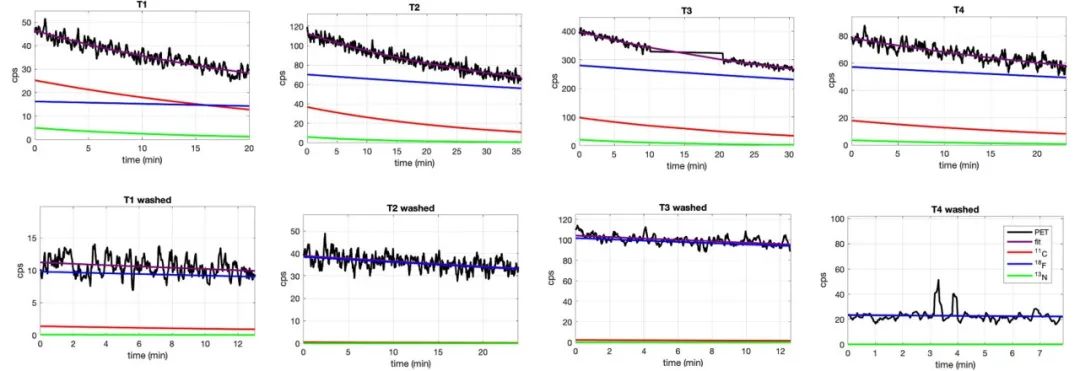
圖5. 在用PBS清洗腫瘤之前(上)和之后(右下),用CeBr3檢測器記錄的T1-T4腫瘤放射性活度衰減曲線(黑色)。對衰減曲線進行指數擬合(紫色),并分別獲取以獲得11C(紅色)、13N(綠色)和18F(藍色)的貢獻。
圖6顯示腫瘤經清洗后不同放射性核素的殘留活度,百分比加權平均值顯示18F的殘留率為59±9%,顯著高于11C和13N的估計殘留率(14±26%)。清洗過的腫瘤的測量結果表明:產生的18F大部分仍滯留在腫瘤中,而所有其他同位素都已被清洗或物理衰變。
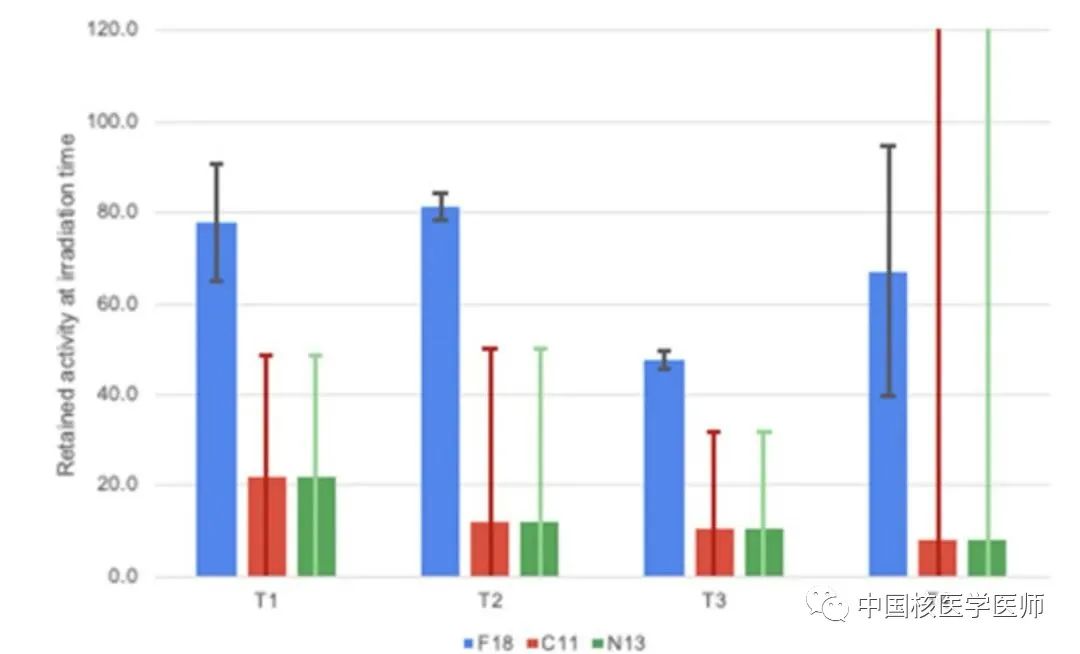
圖6. 在用PBS清洗腫瘤之后,T1–T4腫瘤殘留活性百分比。
05討論
Cho等人[3-5]首次提出使用18-W進行質子射程驗證,并在模型中測試了其可行性。本研究首次在動物模型中測試了這種方法。質子照射生成18F所需的能量閾值較低(2.6MeV),也就能夠在更接近質子射程末端的位置生成18F,從而更精準地驗證質子束射程。本研究結果表明,一半以上的18F被截留在腫瘤內,可以滿足長時間PET/CT顯像。
質子照射18-W后產生的18F能夠滯留在腫瘤細胞中,可能是以下原因:水是一種擴散劑,可自由擴散穿過細胞膜。一旦18O轉為18F離子,由于其電荷,它不再具有穿過細胞膜的能力,如果在細胞質內產生18F,則會被截留在胞內。盡管細胞中的陰離子通道不是高度特異性的,但對氟離子的滲透性很小。
18-W應用于臨床仍有挑戰:為了產生足夠的18F活性,需要在腫瘤內有高濃度的18-W。在本研究中,將18-W緩沖液直接滴注于腫瘤頂部,這通常可用于雞卵腫瘤模型給藥。對于臨床應用,必須探索不同的給藥途徑和照射方案,以確保腫瘤和周圍組織中18-W有較高濃度。18-W比較昂貴,需探索以更低成本獲得和使用18O水的技術。06結論
18-W在質子射程的最后一毫米內可產生18F并滯留于腫瘤細胞內,且18F的半衰期較長,可以在照射后2小時以上進行PET/CT掃描。此研究的結果鼓勵在更大的動物中進行進一步的體內實驗,并使用臨床常規的質子束能量來驗證和評估18-W作為質子治療范圍驗證的可行性。為了在照射體積中獲得足夠高的18O濃度,還需研究不同的給藥途徑和照射方案。
由于質子治療活化的正電子放射性活度很低,通常需要在治療結束后盡快進行PET/CT顯像,以獲取足夠的PET計數,此外,PET圖像需與治療計劃CT精準融合。因此,PET設備需具備足夠高的靈敏度和分辨率,才能精確驗證質子射程。西門子多款PET/CT設備曾應用于質子治療后顯像研究,目前全新系列的PET/CT隨著性能全面提升,優異TOF、高靈敏度和高分辨率使得低活度下的成像質量進一步提高,質子治療范圍的確定更為精準。