構象改變對生物大分子
(名詞解釋>)功能的正確表達至關重要。
補充(來源維基百科):在分子生物學里,一個蛋白質可能為了執行新的功能而改變去形狀;每一種可能的形狀被稱為構象,而在其之間的轉變即稱為構象改變(英文:Conformational change)它通常會改變蛋白質的三級結構,而此結構正好是決定蛋白質功能的重要結構。構象改變可能是由許多不同的因素所造成的,如溫度、配體蛋白和受體蛋白的鍵結等。
基于時間分辨光譜
(名詞解釋>)的X射線晶體學
(名詞解釋>)是近年來出現的一種非常成功的生物分子結構測定方法,能夠準確探測、記錄生物大分子的構象變化,為生物、化學的研究提供重要的參考。
時間分辨X射線衍射方法
(名詞解釋>)由于具有生物分子分辨率高、可在室溫下進行、衍射成像效率高等突出優點,近年來已經逐漸成為生物大分子研究不可或缺的重要工具。
鑒于此,來自瑞典哥德堡大學的研究人員以“Advances and challenges in time-resolved macromolecular crystallography”為題在Science上發表綜述文章。
得益于近年來X射線自由電子激光
(名詞解釋>)的飛速發展,X射線生物大分子的時域和空域成像也因此取得了長足的進步。在這篇綜述中,來自瑞典斯德哥爾摩大學的科學家系統地總結了X射線自由電子激光對生物大分子成像所帶來的變革性影響,詳細闡述了該成像方法在飛秒時間尺度上卓越的分辨能力,并對時間分辨X射線晶體學未來應用過程中面臨的挑戰、潛在的前景做了充分的討論與展望。
 圖1:光敏蛋白的時間分辨串行晶體學研究的示意圖 (圖源:Science 373, 980 (2021))
圖1:光敏蛋白的時間分辨串行晶體學研究的示意圖 (圖源:Science 373, 980 (2021))
在同步輻射
(名詞解釋>)上使用多色x射線脈沖(Laue衍射)的數十年工作奠定了時間分辨大分子晶體學領域的實驗基礎。光驅動的生物反應可以使用短激光脈沖在整個晶體中快速啟動,因此成為該領域的一個主要焦點。
10年前,研究人員在X射線自由電子激光器上首次實現了串行晶體學(SFX)
(名詞解釋>)。在這種方法中,X射線衍射數據是從一系列微晶中收集的,這些微晶的最大尺寸通常小于10μm,然后將來自數千個微晶的X射線衍射數據合并成一個完整的數據集。X射線自由電子激光串行晶體學實驗的樣品輸送最初依賴于液體微射流,但此后發展了許多其他樣品輸送技術,每種技術都有其自身的優缺點。串行晶體學克服了限制時間分辨勞厄衍射的許多技術限制,從而推動了時間分辨大分子晶體學的發展。
同步加速器和X射線自由電子激光
當電子發生振蕩時,它們發出電磁輻射。在大型X射線用戶設施中,電子束被加速到相對論能量,并通過在陣列內以相反方向排列的周期性磁鐵陣列(波蕩器)(如圖2)。這些交變磁場使得通過的電子發生振蕩,從而產生X射線。
 圖2:X射線光源示意圖。(A) 同步輻射光源 (B) X射線自由電子輻射光源 (圖源:Science 373, 980 (2021))
圖2:X射線光源示意圖。(A) 同步輻射光源 (B) X射線自由電子輻射光源 (圖源:Science 373, 980 (2021))
同步加速器是圓周通常為500到1400米的圓形機器,其中的波蕩器長度一般小于5米的。由700到3400米長的直線加速器將電子引導到50到150米長的波蕩器中,從而產生X射線自由電子激光。直線加速器產生的電子束比同步加速器(持續時間約100ps)要緊密得多(持續時間約10fs),因此X射線自由電子激光脈沖要短幾個數量級。
X射線自由電子激光使用的較長波蕩器有助于反饋機制,即波蕩器早期產生的X射線與電子束相互作用,從而產生相干激光過程。激光產生的X射線光子多出許多數量級,在1Å波長下工作的X射線自由電子激光通常可以為用戶實驗提供每脈沖1011到1012個X射線光子。
對于大分子晶體學研究,通過使用微射流在聚焦的X射線自由電子激光光束上連續注入微米大小的晶體(微晶),可以解決樣品可能被探測光源破壞的問題。以X射線自由電子激光光源的重復頻率讀取衍射數據,并將大量微晶的數據合并在一起就能夠重建出完整的衍射數據。因為數據是使用持續數飛秒的X射線自由電子激光脈沖以串行方式收集的,所以這種方法被稱為串行飛秒晶體學。
盡管歷史上第一批串行飛秒晶體學結構分辨率并不高,但一旦將X射線波長接近1Å的實驗站投入運行,該方法就可以迅速擴展到高分辨率成像。
串行飛秒晶體學
結構生物學家和同步輻射裝置之間長達50年的合作凸顯了X射線源及其使用者之間的相互依賴性。11年前,由直線加速器相干光源(LCLS)首次實現的1.5Å波長的X射線自由電子激光,對結構生物學中的生物大分子成像產生了顛覆性的影響。
X射線自由電子激光是一種革命性的光源,因為它允許極短而強烈的X射線脈沖聚焦在非常小的樣本上,從而促進了許多科學領域的重大進展。
模擬預測,生物樣品的原子會在X射線自由電子激光暴露過程中電離,樣品會被破壞,但如果X射線自由電子激光脈沖在樣品爆炸之前通過樣品,則可恢復可解釋的衍射數據。這一想法后來被稱為“破壞前的衍射”,通過觀察蛋白質晶體在70到300 fs(1 fs=10)的X射線自由電子激光脈沖下衍射功率如何下降,實驗驗證了這一想法−持續時間為15秒。
時間分辨串行飛秒晶體學
串行晶體學解決了許多限制時間分辨勞厄衍射
(名詞解釋>)更廣泛應用的技術障礙。由于微晶不斷被替換(圖3),串行晶體學完全消除了研究系統必須返回其靜止狀態以循環數據收集協議的約束。通過使用準單色X射線自由電子激光脈沖,也巧妙避免了勞厄衍射易受到晶體雜質、錯位等缺陷干擾的缺點該脈沖的光子能量帶寬通常約為X射線光子能量的0.1%,幾乎比同步加速器源勞厄衍射研究中常用的范圍窄兩個數量級。
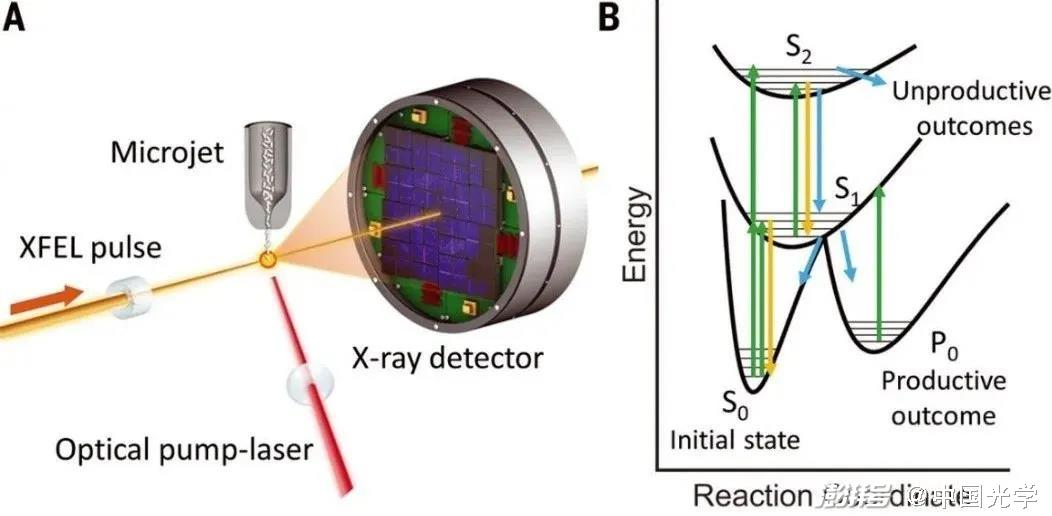 圖3:光激發和多光子途徑示意圖 (圖源:Science 373, 980 (2021))
圖3:光激發和多光子途徑示意圖 (圖源:Science 373, 980 (2021))
同時,由于X射線自由電子激光光源中的大的逐點能量和光譜波動、微晶質量的變化、晶體取向的隨機取樣,在使用這些數據時出現了新的挑戰,在飛秒曝光期間,晶體沒有時間旋轉,因此只能收集部分衍射強度。時間分辨串行飛秒晶體學的一個里程碑式演示使用光敏黃蛋白(PYP)
(名詞解釋>)微晶對使用X射線自由電子激光輻射測量的光誘導電子密度變化與早期時間分辨勞厄衍射研究進行基準測試。
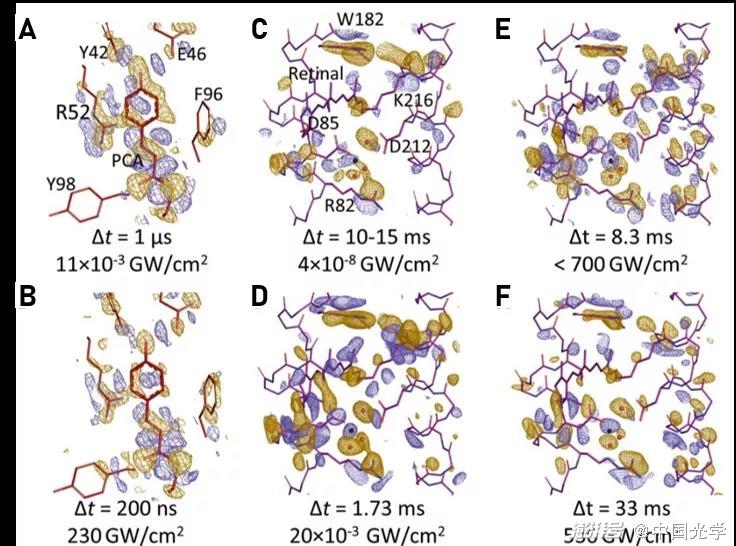 圖4:基于差分傅里葉電子密度圖得到蛋白質空間構型的演化圖像 (圖源:Science 373, 980 (2021))
圖4:基于差分傅里葉電子密度圖得到蛋白質空間構型的演化圖像 (圖源:Science 373, 980 (2021))
與使用較大晶體進行的勞厄衍射研究相比,微晶較低的光密度允許獲得較高比例的光激發PYP,并且這種方法提高了觀察到的電子密度變化的質量。雖然單個衍射強度測量之間的實驗波動較大,但這種噪聲可以通過合并大量微晶的衍射數據來減小。在實驗中,利用10000到50000張經過處理的衍射圖像就可以實現高質量的差分傅里葉電子密度圖。
展望未來
自從七年前首次根據時間分辨串行飛秒晶體的數據計算得出高質量差分傅里葉電子密度圖以來,這一里程碑大大促進了隨時間變化的大分子系統結構變化的研究。時間分辨串行飛秒晶體學還開辟了超快結構生物學領域,對可視化蛋白質構象變化過程的研究產生了革命性的推動作用。
預計在不遠的未來,這些進展將使該領域超越了研究光敏蛋白質的限制,并為闡明多種酶的結構機制提供了可能。鑒于目前的發展,我們相信時間分辨X射線衍射和新興的單粒子冷凍電子顯微鏡方法,將會迅速發展大生物分子研究的重要實驗方法,從而為活細胞的化學反應提供全新的研究工具。



