要是能給抗體藥物上安上化療藥物“彈頭”,是不是就能更精準地打擊癌細胞了?
基于此,一種被稱為“生物導彈”的ADC(抗體藥物偶聯(lián)物)橫空出世。2000年首個ADC批準上市,卻一波三折后于2010年退市。
但藥企和研發(fā)人員沒有放棄。因為,ADC的魅力不只是強大的腫瘤殺傷力,它還有著“起死回生”的能力。
起死回生指的是藥物而不是人。成為ADC“彈頭”后,不少曾經(jīng)因毒性太強被判“死刑”的化療藥物,迎來了施展手腳的新機會。比如曾經(jīng)的美登素、海兔毒素。
可以說,ADC的出現(xiàn)改變了許多藥物的命運。同時,ADC命運也被毒素改變著。
從化療藥物到微管蛋白抑制劑到DNA損傷劑,ADC的“彈頭”經(jīng)歷了三代更迭,效果從最初的步槍升級為大炮,ADC也成為了藥企研發(fā)熱點。
截至2021年6月,國內(nèi)申報臨床的ADC新藥已達36款。目前,全球獲批上市的ADC藥物也已有14款。Nature預測,2026年已上市ADC藥物全球市場規(guī)模將達164億美元。
過去幾年,藥企通過對“彈頭”等方面的改進,已經(jīng)讓我們看到了ADC的無限潛力。與此同時,一個不爭的事實是,還有一部分腫瘤可以阻擋彈頭的攻擊,我們還需要更多樣的“彈頭”,攻打不同的腫瘤。
人類與腫瘤的戰(zhàn)爭仍在持續(xù),尋找最強的ADC“彈頭”的任務將繼續(xù)下去。
1. ADC的理想彈頭長什么樣?
ADC就像攜帶核彈頭的導彈,講究的是一擊即中,打歪了可不是鬧著玩的。因此,它對導彈本身的制導精確性、導彈與彈頭的綁定穩(wěn)固性、彈頭的殺傷能力要求都很高。
換句話說,抗體+連接子+小分子毒素組成的ADC是否能成功,每一部件都很重要。
如圖所示,呈“Y”字型是典型的抗體結(jié)構(gòu),其左右的“小紅球”就是小分子毒素藥物,抗體和藥物的連接部分就是連接子。抗體作為導航系統(tǒng),幫助ADC準確尋找到腫瘤細胞;毒性的小分子化合物作為ADC的彈頭,在腫瘤細胞內(nèi)釋放,負責殲敵;連接子則負責連接藥物和抗體,確保藥物在到達目標地點之后再脫落,以免誤傷正常細胞。
說起來簡單,做起來難。僅選擇ADC彈頭這一問題,就難倒了不少研究人員。
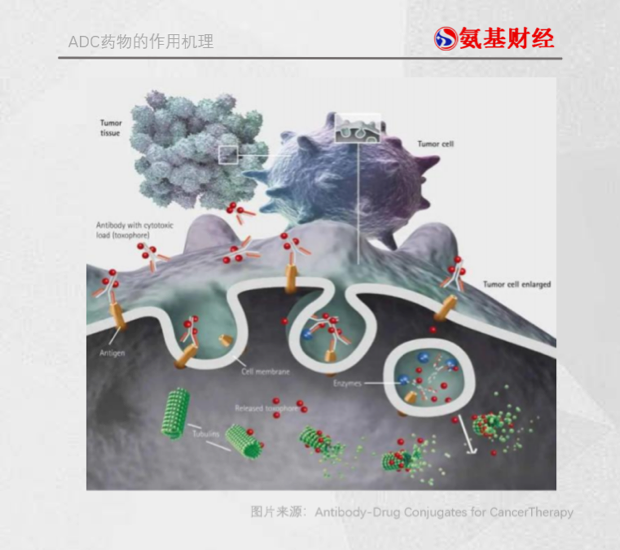
作為彈頭的細胞毒藥物身處與癌細胞作戰(zhàn)的最前線,可以說ADC藥物的殺傷力和副作用如何,很大一部分取決于彈頭。
毒性不夠,腫瘤細胞依舊可以春風快活;毒性太強,又容易殃及池魚。因此ADC對于細胞毒藥物的要求頗為嚴苛。要想成為ADC理想的彈頭,以下這四點缺一不可。
第一,需要有較高的細胞毒性。
抗體是一個運輸效率比較低的工具,在去往腫瘤細胞內(nèi)部的路上,藥物毒性層層降低,再經(jīng)過腫瘤細胞的包吞作用后,能真正進入腫瘤內(nèi)部發(fā)揮作用的彈藥所剩無幾。
所謂包吞,你可以理解為癌細胞吃了ADC,經(jīng)過消化后,ADC的毒性自然大大降低,只有大約0.1%的藥物能夠抵達腫瘤細胞內(nèi)部。因此想要殺傷腫瘤細胞,彈頭毒性要足。
第二,需要分子量較小。
ADC毒素需要具備亞納摩爾級別的毒性分子。這并不難理解,大分子的藥物會使得ADC整體分子量增加,很可能在進入腫瘤細胞之前,先被免疫系統(tǒng)當作入侵者清除掉。并且,小分子的毒素行動更利索,能穿過細胞膜,從腫瘤細胞擴散到鄰近的腫瘤細胞,起到旁殺作用。
第三,作用機制要清晰。
由于ADC藥物的毒素是在被包吞進入腫瘤細胞后才發(fā)揮作用,因而需要毒素的作用靶向細胞內(nèi)的靶點。
第四,可以被修飾。
某些細胞毒素,比如長春花堿和甲氨蝶呤偶聯(lián)到抗體上后幾乎失去抗癌能力,無法作為ADC的彈頭。因此,一個合格的ADC彈頭,必須要做到,即使采用化學方法偶聯(lián)到抗體上后,仍能保留抗腫瘤活性。
基于這些苛刻條件,少有小分子毒素能入得了ADC的法眼。自2000年第一款ADC藥物Mylotarg上市后,ADC經(jīng)歷了10年的空窗期。Mylotarg也因為連接子不穩(wěn)定、彈頭毒素不夠等問題退出歷史舞臺。
不過,在未有ADC藥物上市的這段時間中,研究人員一直沒有放棄尋找合適的彈頭。
2. 彈頭升級,ADC步槍變大炮
早期設計第一代ADC藥物時,研究人員曾嘗試將傳統(tǒng)的化療藥物作為毒素偶聯(lián)抗體,如甲氨蝶呤、長春花堿和阿霉素。但是,由于化療藥物本身毒性不夠強,和ADC結(jié)合后再經(jīng)過層層消化,毒性所剩無幾,甚至低于化療藥物本身的療效,基本宣告失敗。
不過,隨著研究人員找到了比傳統(tǒng)化療藥物毒性高約100~1000倍的新型高效細胞毒性化合物,ADC有了更加合適的毒素選擇。
在被用于ADC的彈頭之前,這些高細胞毒性化合物一度毫無用武之地。因為它們毒性都太強了,作為單藥化療使用時,在殺滅腫瘤的同時,副作用令人體難以承受。
比如美登素,它的作用機制明確,有極強的抑制腫瘤細胞增殖的能力,但同時神經(jīng)毒性和胃腸道反應等毒副作用太強,臨床上早已被禁止直接用于人體治療。
甲之砒霜乙之蜜糖。對ADC來說,這些高效細胞毒性化合物,不正是ADC一直以來苦苦追尋的理想子彈嗎?
于是,隨著有這些高效的毒素出現(xiàn),ADC也開始升級換代,靠著毒性更強的毒素,ADC的效果也由步槍升級為大炮。
升級后的二代ADC多選擇微管蛋白抑制劑做毒素。微管蛋白是微管的構(gòu)成,微管是細胞骨架的主要成分,使用微管蛋白抑制劑能夠干擾有絲分裂,改變細胞的細胞骨架結(jié)構(gòu),導致腫瘤細胞死亡。因為腫瘤細胞分裂速度比大多數(shù)正常細胞更快,所以微管蛋白抑制劑藥物對癌細胞特別有效。
簡單來說,就是讓腫瘤細胞無法正常有絲分裂,使其“斷子絕孫”。微管蛋白抑制劑又可以分為兩種,一種是以MMAE、MMAF為代表的海兔毒素衍生物,它可以促進微管蛋白聚合,使微管生長不受調(diào)控;另一種就是美登素衍生物,如DM1、DM4。
不過,由于MMAE、MMAF的細胞毒性強于DM1的細胞毒性,因此使用更加廣泛。在已上市的ADC藥物中,僅T-DM1一款采用DM1毒素。Adcetris、Polivy、Padcev、維迪西妥單抗均采用MMAE,Blenrep則采用MMAF。
雖然比第一代的毒素毒性強了許多,但微管蛋白抑制劑也存在一些問題。比如它只能針對處于細胞分裂期的腫瘤細胞,對非分裂和靜態(tài)細胞的癌細胞,無計可施。
因此,能作用于整個細胞周期的DNA抑制劑,成了不少三代ADC的選擇。
DNA抑制劑通過雙鏈斷鏈、烷基化、嵌合、交聯(lián)等方式破壞DNA,使腫瘤細胞“嚴重偏癱,半身不遂”。DNA抑制劑的代表毒素有卡奇霉素、拓撲異構(gòu)酶Ⅰ抑制劑、PBD(吡咯并苯二氮卓類)等。

與微管蛋白抑制劑相比,DNA抑制劑的表現(xiàn)看起來更加優(yōu)秀。
一方面,微管蛋白抑制劑主要作用于細胞分裂期,對不分裂的癌細胞沒有殺傷效果。而DNA抑制劑能夠作用于整個細胞周期,對實體瘤也具有治療作用。
另一方面,腫瘤細胞內(nèi)微管蛋白抑制劑的靶標數(shù)遠超DNA抑制劑。這也就意味著,相比于令DNA停止工作,令微管蛋白停止工作需要更大的藥物劑量。
而在臨床效果方面,使用DNA拓撲異構(gòu)酶抑制劑DXd作為彈頭的第三代ADC藥物DS-8201,也確實展現(xiàn)出了更好的效果。在與二代ADC代表T-DM1的頭對頭臨床試驗中,相比T-DM1,DS-8201讓患者病情進展的風險降低了72%,死亡風險降低了45%。
3. 尋找ADC的最強彈頭
當然,抗體+連接子+小分子毒素這幾個因素是聯(lián)動的,單獨優(yōu)化某一個很難起到實質(zhì)性改善的作用。DS-8201也正是在小分子毒性和連接子這兩方面均做了提高,使整個藥物有了質(zhì)的飛躍。
其中,連接子的優(yōu)化升級也頗為重要。DS-8201之所以受到極高的認可,新的彈頭功不可沒,最關鍵的還是連接子的進步。有關連接子的討論,氨基君留待下回分解。
說回ADC彈頭,雖然經(jīng)歷三代更替,由步槍變大炮,威力大增。但目前的彈頭仍存在一些局限性,比如有限的實體瘤滲透性和毒性,限制了其在實體瘤的應用。
并且與其它抗癌藥一樣,ADC藥物也會產(chǎn)生耐藥性。因此我們?nèi)匀恍枰獙ふ腋鼌柡Φ膹楊^,讓ADC從大炮升級到導彈。
實際上,已經(jīng)有藥企選擇研發(fā)一些其它類型的彈頭,比如免疫刺激劑、促進凋亡的BCL-xL抑制劑等。
美國Seaen-Bio公司研發(fā)的Vicineum就是使用免疫毒素作為彈頭,通過破壞具有特異性標記細胞發(fā)揮藥效。市場也頗為看好這一路線。齊魯制藥已經(jīng)通過首付款1200萬美元,后續(xù)里程碑款2300萬美元,獲得了這款藥物在國內(nèi)的權(quán)益。
艾伯維的ABBV-155則使用BcL-xL抑制劑作為彈頭。Bcl-xL凋亡抑制劑是凋亡Bcl-2家族成員,其過度表達是癌細胞獲得凋亡抵抗的機制之一。理論上通過阻斷Bcl-xL上BH3結(jié)合域的藥物可以觸發(fā)癌細胞凋亡,不過該藥物目前仍處于臨床Ⅰ期試驗階段,效果如何還不好說。
不過,這些關于ADC彈頭的創(chuàng)新大多來自國外藥企,國內(nèi)藥企主要選擇跟隨策略,多是選擇機制已經(jīng)較為成熟的微管抑制劑和DNA抑制劑。
比如東耀生物的TAA013、恒瑞醫(yī)藥的SHR-A1201均是選擇DM1作為毒素,榮昌生物的RC48、浙江醫(yī)藥的ARX788均選擇MMAF作為毒素。
這也沒錯,畢竟在老路上走,不容易出錯。但要想真正贏下這場ADC大戰(zhàn),還需要更多新的突破。
隨著技術的發(fā)展,越來越多以前不可能成藥的物質(zhì)有了成藥的可能性,ADC的彈頭的可選擇性也越來越多。
那么未來究竟ADC的最強彈頭會在哪里出現(xiàn)呢?我們讓子彈再飛一會。