1 X射線自由電子激光特性與“損傷前探測”
X射線是波長為0.01—10 nm的電磁波,由倫琴發(fā)現以后很快被用于研究物質的內部結構。隨著人造X射線光源亮度和穩(wěn)定性的提高(圖1),X射線被越來越廣泛地應用于物理、化學、生物、材料、醫(yī)學等諸多領域。根據麥克斯韋方程,對高能電子進行加速(改變速度或/和運動方向)時會輻射電磁波,調整電子能量和加速度就能夠獲得所需特定波長的X射線。常用的X射線源包括電子射線管,通過高能電子轟擊金屬靶獲得X射線。亮度更高的X射線可以在同步輻射裝置產生。電子在同步輻射裝置的電子儲存環(huán)(包括直線部分和裝備了磁場的轉彎部分)中高速運動達到準光速,再利用強磁場對電子進行調制,從而輻射X射線(輻射的波長由于相對論效應被縮短)。同步輻射設施能夠產生穩(wěn)定的并且波長可調的X射線用于大量實驗研究。最近涌現的自由電子激光設施(XFEL)的原理也是利用周期性磁場調制通過其中的準光速電子而獲得X射線輻射[1,2]。電子槍發(fā)射的電子首先被壓縮為飛秒脈沖,然后通過直線加速器獲得動能,最后接近光速的電子進入波蕩器陣列(undulator array)產生的周期性橫向磁場,電子被磁場調制從而發(fā)射電磁波,這些電磁波又對行進中的電子產生反饋,最終把單個脈沖包含的全部電子調制成為同相位震蕩的電子,發(fā)射全相干的X射線,也就是X射線自由電子激光。

XFEL激光脈沖有三個特點,即全相干、極高的亮度以及飛秒寬度的脈沖(1 fs=10-15 s)。這三個特點使得XFEL能夠對微米尺寸的蛋白質分子晶體以“損傷前探測”的模式進行衍射測量[4]。“損傷前探測”實驗模式可以通俗地理解為,將幾萬億個X射線光子壓縮為飛秒脈沖,對樣品進行“飽和攻擊”。由于X射線帶來的輻射損傷對晶體的破壞效應需要一定的時間才展現出來(動力學模擬的數據顯示大約10 fs以后,單個蛋白分子才會因為庫侖排斥力導致顯著結構形變[5]),而XFEL衍射測量在樣品破壞之前就已經完成。當然,每個晶體被XFEL脈沖照射一次之后就因受到“飽和攻擊”而損壞,所以需要大量晶體依次進行衍射,也就是串行晶體衍射(serial crystallography)。制備高品質的蛋白質單晶是限制蛋白質晶體學的一個主要瓶頸。很多有重要生物學、醫(yī)學意義的膜蛋白很難形成足夠大的晶體用于同步輻射的衍射實驗,但是在一種被稱為脂立方相(lipidic cubic phase,LCP)的特殊磷脂分子環(huán)境中,可以逐漸排列成為小晶體[6]。自從2013年首次利用XFEL解析出原子分辨率的GPCR蛋白分子結構以來[7],串行晶體衍射方法在這類感知外界信號的受體蛋白質研究中發(fā)揮了重要作用[8]。超短的XFEL脈沖還促進了對蛋白質分子結構變化過程(即動力學)的研究[9]。錄制“分子電影”不再是一個夢想,如何錄制“分子電影”正是本文重點介紹的內容。
2 錄制“分子電影”的難點和解決方案
靜止的三維結構可以告訴我們蛋白質的某些特點,比如活性位點、表面特性等,并推測潛在的作用機制。這類似于看到了一個陌生人的雕像(或者蠟像),根據外形、身材、長相等,具有豐富經驗的人力資源經理(或者偵探)可以推測其從事的工作類型、有何特殊技能等。基于分子的靜態(tài)結構(通常對應的是最穩(wěn)定的狀態(tài),即基態(tài))理解生物分子工作機理,難免有偏差、甚至錯誤。“分子電影”可以在三維空間結構的基礎上增加時間維度,把多個靜態(tài)結構按照時間順序串聯起來,觀看“工作狀態(tài)”的蛋白分子動態(tài)過程,加深和提高對分子機制的理解。拍攝“分子電影”需要通過“泵浦—等待—拍攝”三部曲(簡稱“泵浦—探測”)來實現,通過調整“等待”時間,測量不同時刻的狀態(tài)(圖2)。

蛋白質分子晶體作為“演員”就位之后,錄制“分子電影”還需要三個要素:攝像器械,能夠指揮演員的導演,以及專業(yè)的剪輯。
(1)攝像器械,包括能夠探測原子分辨率結構的光源、探測器等。XFEL飛秒脈沖和配套的二維像素陣列探測器正好滿足這些硬件需求,其中XFEL的超高亮度可以探測微米尺寸的晶體產生的高分辨率衍射信號。XFEL的飛秒脈沖能夠將“曝光時間”縮短到飛秒尺度,是研究超快結構變化的基石。
(2)能夠指揮演員的導演,指的是有效的“泵浦”方法。比如,對于感光蛋白質分子結構變化的激發(fā),脈沖激光就是最佳的導演。利用激光對蛋白質分子進行“泵浦”,可以迅速、準確地啟動蛋白質分子的結構演化。除此以外,溫度、酸堿度、溶液中反應物的混合等都可以作為“泵浦”方法,啟動分子結構演化。
(3)專業(yè)的剪輯,指的是數據分析方法和軟件。“剪輯”是從拍攝到的大量數據中,提取出真正的信號,并且轉化為與特定的時間點一一對應的高分辨結構。有了這些關鍵時間點的結構,最終才能獲得“分子電影”。
先介紹一下攝像器械的細節(jié)。XFEL裝置的原理以及XFEL激光脈沖的物理參數不是本文的重點,有興趣的讀者可以從《物理》關于XFEL的專題中獲得更多的信息(2018年第7期)。XFEL的飛秒脈沖賦予其超高的峰值亮度,是其成為“分子電影”攝像器械的關鍵屬性。XFEL脈沖到底有多亮?如果地球上感受到的太陽亮度為1,第三代同步輻射裝置的X射線亮度大約是100億,XFEL照射的亮度是100億×100億(具體指的是峰值亮度。XFEL單發(fā)飛秒脈沖包含的光子數約等于同步輻射設施一秒鐘累計發(fā)射的光子總數)。正因如此,用同步輻射X射線只能測量到低分辨率衍射信號的微米尺寸晶體,通過XFEL脈沖的曝光,經常能夠得到原子分辨率的信號(即,在電子密度分布圖中可以區(qū)分相鄰原子)。另一個值得考慮的因素是,生物分子需要水環(huán)境維持其生理狀態(tài),所以單個生物分子發(fā)出的X射線信號會淹沒在水溶液產生的背景強度中。在蛋白質分子晶體中,周期性排列的分子能夠利用X射線干涉效應將信號集中并放大到晶體對應的布拉格點(Bragg spots)。假想一個蛋白質分子占據邊長為10 nm的立方體空間(晶體的基本單元,也被稱為晶胞),將其排列為邊長1000 nm(即1 μm)的立方晶體,則能夠包含100×100×100個蛋白質分子。我們知道,X射線衍射信號的強度與晶體中包含重復單元個數N(對于前面的示例N = 106)的平方成正比,因此1 μm的晶體理論上能夠把10 nm的單個分子信號放大了1萬億倍(106×106),令其衍射信號從水溶液的背景信號中凸顯出來。
再說導演。導演,主要責任是對分子進行“泵浦”。蛋白質分子在平衡態(tài)傾向于保持其最低能量結構。“泵浦”的有效性(導演是否合格)需要至少從兩個方面考慮:對蛋白分子激發(fā)的成功率和對所測量的分子樣品激發(fā)的同時性。激發(fā)成功率包括收到激發(fā)信號的分子所占比例和被激發(fā)之后啟動結構演化的比例。比如,用脈沖激光作為“泵浦”方法,需要調控泵浦脈沖的光子密度(即光脈沖能量),盡可能地增加光子數,又要保證分子晶體樣品不會因為光照太強而受到損傷或者單個蛋白吸收多個光子產生副產品。吸收光子之后,蛋白質分子從基態(tài)躍遷到激發(fā)態(tài),既可以朝著預期的結構演化,也可以回到基態(tài)。為了能夠增加激發(fā)成功率,還需要選擇適宜的激光波長(即單個光子的能量)。激發(fā)就類似跑步比賽中的發(fā)令槍,告訴蛋白質分子開始結構演化。為了讓蛋白質分子“同時”行動,就要求激發(fā)信號盡可能“同時”到達所有的蛋白質分子。從這個角度考慮,激光脈沖是最佳的“泵浦”方法。然而,激光脈沖只適用于“泵浦”感光蛋白質分子,很多重要的蛋白質分子需要其他方式激發(fā),比如具有催化功能的各種蛋白酶需要與底物結合之后才啟動結構變化。微流混合的方法能夠促進蛋白酶與反應底物進行結合,啟動催化反應。在啟動結構變化的同時性和有效性方面,微晶比更大尺寸的晶體有顯著的優(yōu)勢:無論是光脈沖激發(fā),還是微流混合激發(fā),小尺寸的晶體都便于信號深入晶體內部。
最后是專業(yè)的剪輯。如前文所述,任何“泵浦”的方法都不能保證激發(fā)100%的生物分子。這給數據分析帶來了巨大的挑戰(zhàn),而這就是“專業(yè)的剪輯”大顯身手的地方。傳統(tǒng)晶體學數據分析已經獲得長足的發(fā)展,使用成熟的軟件,通過標準的流程,就可以從實驗數據重構實空間的電子密度,并結合蛋白質的氨基酸序列構造原子模型。在“泵浦—探測”晶體衍射實驗中,“泵浦”之后任一時刻測量的數據都是多種結構疊加形成的信號,已有的軟件還不能夠直接用于分析這種多態(tài)混合的數據。因此,在數據分析方面需要開發(fā)新的方法分離出單個結構對應的信號,并整合其他實驗方法獲得的信息進行交叉驗證。下文將結合具體的蛋白質分子體系,詳細介紹“分子電影”制作的關鍵步驟,即如何確定主要的結構類型和所占比例,并且從混合的信號中分離出該時刻每種單一結構對應的結構信息。
具備“攝像—導演—剪輯”三要素之后,就可以開展時間分辨的晶體衍射實驗。接下來,我們基于對光驅動的氯離子輸運蛋白質的動力學研究成果,介紹分子電影的拍攝和制作過程。
3 視紫紅質蛋白如何利用光子能量輸運離子
3.1 視紫紅質蛋白是細胞的感光分子
自然界中有大量的生物能夠利用太陽能驅動細胞功能,比如光合作用、晝夜節(jié)律調節(jié)、維持細胞內外離子濃度等。針對太陽能在細胞內轉化的研究在能源、醫(yī)療、健康等多個領域都有重要意義。在眾多的感光蛋白體系中,視紫紅質蛋白(rhodopsin)是一個“寵兒”,作為模式系統(tǒng)得到了廣泛的關注和研究(圖3)[10]。

視紫紅質蛋白屬于跨膜蛋白,具有7重跨膜螺旋結構,和哺乳動物細胞膜上著名的G蛋白耦合受體蛋白(GPCR)在結構上高度相似,也與視網膜上感光的視蛋白(opsin)緊密相關。視紫紅質蛋白結合了一個感光的視黃醛分子(retinal),并將其包裹在蛋白內部(圖3)。視黃醛分子能夠吸收光子,并且利用獲得的能量完成異構化(isomerization)。由于視黃醛與視紫紅質蛋白的緊密結合,視黃醛的異構化會引發(fā)蛋白質結構的變化,改變蛋白在構象空間的勢能面:暗狀態(tài)的結構對應的能量被抬高,推動結構朝著新的能量低點演化。這些視紫紅質蛋白利用光能可以輸運多種離子,包括氫離子、鈉離子、氯離子等(圖3(a))。其中,氫離子輸運蛋白最早被發(fā)現,得到了最豐富的研究。因為是在細菌中發(fā)現的,所以被稱為菌視紫紅質(bacteriorhodopsin,bR)。綜合多種方法的研究成果,人們已經初步勾勒出光子吸收導致的視黃醛異構化過程,以及在bR分子中引發(fā)的結構演化。最近,利用XFEL開展的“泵浦—探測”實驗中,科學家揭示了光子驅動bR分子形成的多個中間態(tài)的原子分辨率結構[11—14],為理解氫離子輸運動力學過程和分子機理提供了豐富的信息。然而,氫離子與X射線的相互作用非常弱(氫離子周圍沒有電子能夠與X射線電磁波相互作用),作為被輸運的“主角”,氫離子的位置不能直接測量,必須根據氨基酸、視黃醛、以及周圍的水分子的化學狀態(tài)做出推測。氯離子則具有得天獨厚的優(yōu)勢,因為其帶有18個電子,對X射線有很強的散射效應,所以能夠通過X射線的信號直接測定氯離子的位置信息,這也是氯離子輸運蛋白(chloride ion pumping rhodopsin,ClR)作為研究體系的優(yōu)勢。
ClR蛋白的結構如圖3(c)所示,視黃醛分子通過共價鍵結合在第7個跨膜螺旋中間部位的賴氨酸(Lysine-235)上,結合部位形成了一個席夫堿原子集團,帶有一個正電荷(圖3(b))。在黑暗環(huán)境中,氯離子與席夫堿、周圍的氨基酸以及附近的水分子形成多個氫鍵,被束縛在一個穩(wěn)定的結合狀態(tài)。通過時間分辨光譜的研究,我們知道,光照之后,視黃醛分子吸收一個光子被激發(fā),全反式的碳鏈中C13=C14的雙鍵翻轉大約180°,導致其構型變?yōu)?ldquo;13-順式”(圖3(b))。視黃醛分子的異構化過程在百飛秒至1 ps時間內完成,而視紫紅質蛋白受此驅動的結構演化通常需要幾十毫秒[15]。在這幾十毫秒的時間內,視紫紅質蛋白將氯離子運送到細胞內部,包括跨越蛋白質中間一段長度約10 Å的疏水氨基酸區(qū)域的能量勢壘(圖3(d))。在這個過程中,蛋白質的結構是如何演化的,需要通過“泵浦—探測”實驗研究才能揭曉,其中視黃醛分子異構化之后很短時間內發(fā)生的超快動力學變化必須用XFEL的飛秒脈沖才能捕捉。
3.2 用LCLS的X射線激光拍攝分子電影
2017—2018年,我們與韓國延世大學Weontae Lee研究組合作,利用美國斯坦福線性加速器中心(SLAC)國家實驗室的XFEL設施開展了一系列的時間分辨晶體學研究。在美國自然科學基金B(yǎng)ioXFEL科技中心研究人員和北京師范大學張文凱教授團隊的幫助下,解析出了ClR蛋白質分子在黑暗環(huán)境以及光激發(fā)之后100 ps之內四個時刻的原子分辨率結構[16]。這是世界上首次觀看到光驅動氯離子輸運的“分子電影”,詳細揭示了視黃醛異構化對氯離子、蛋白質結構的影響。在這個電影中,氯離子初期的運動與預期方向相反,先朝著細胞外的方向短暫移動,再向細胞內擴散。這種出乎意料的運動模式乍看違背常理,其實可以通過簡單的受力分析獲得合理的解釋。
如前文所述,為了捕捉超快的結構變化,先進的“攝像裝置”必不可少。直線加速器相干光源(Linac Coherent Light Source,LCLS)是世界上第一個硬X射線自由電子激光設施,是美國能源部資助SLAC國家實驗室在其原有的直線加速器的基礎上建設的,耗資大約4億美元。2009年首次成功發(fā)射X射線激光之后,取得了一系列的科研突破,而飛秒串行晶體學也被《科學》選為2012年“十大突破”之一[17]。LCLS每秒最多發(fā)射120個XFEL脈沖,可以將1012個光子壓縮在幾十飛秒的單發(fā)脈沖之內——這是用微晶進行高時空分辨衍射的硬件基礎。
3.3 飛秒激光指揮蛋白質的統(tǒng)一行動
飛秒激光器作為“泵浦”裝置,在這個實驗中充當“導演”職務。為了確定“泵浦”激光的最佳波長和功率,張文凱實驗室系統(tǒng)地測量了ClR蛋白的吸收光譜和激發(fā)后1納秒之內多個時刻的瞬態(tài)光譜。結合LCLS的激光儀器參數,研究團隊最終將泵浦激光的波長確定在550 nm,并且估算出泵浦激光器的單個脈沖能量需要達到mJ/mm2的量級。由于“泵浦”和“探測”都采用飛秒激光脈沖,保證了激發(fā)的高度同時性和測量的時間分辨率。XFEL脈沖是由2km外的電子槍發(fā)射出來的,到達樣品的時間有一定的不確定性(抖動范圍大約在1000fs量級)。為了進一步提高時間延遲的準確性,實驗過程中使用“計時工具”(time-tool)來校正每次測量的時間延遲(XFEL脈沖和泵浦激光脈沖到達樣品的時間差)[18]。通過設定“泵浦—測量”的時間差,我們測量了多個重要時間點的結構信息。
由于單個晶體被激發(fā)后測量一次就被XFEL脈沖損傷,需要將大量ClR蛋白晶體依次輸送到X射線焦點進行衍射測量。根據經驗,一組完整的衍射信號需要累積幾萬顆晶體產生的衍射圖譜,才能夠達到原子分辨率。當然,所需衍射圖譜數量依賴多個因素,比如晶體的尺寸、晶胞的參數和對稱性、XFEL脈沖的能量等。在對ClR的實驗中,單個時間點的衍射信號包含2.4—4.8萬張有效測量的衍射圖(即能夠進行指標化分析確定衍射圖像中衍射斑對應的密勒指數,將衍射強度匯總到傅里葉空間)。考慮到泵浦激光的焦斑超過150 μm,我們需要在連續(xù)兩個泵浦脈沖的時間間隔,把被上一個脈沖激光照射的樣品全部移出焦斑占據的空間,才能保證樣品只被照射一次。這極大地增加了晶體樣品的損耗,亟需在將來的實驗中改進實驗技術來降低對樣品量的需求(比如縮小泵浦激光的焦斑)。
在2017、2018年兩次(共7天)實驗中,我們首先收集了光照之前的晶體衍射信號(需要指出的是,為了保證蛋白質分子處于基態(tài),樣品的制備是在暗室中進行的);然后用“泵浦—探測”的方式,收集了光脈沖激發(fā)之后1 ps到25 ms之內多個時間點的信號,累積超過100 TB的原始數據。接下來就需要“專業(yè)的剪輯師”上場,對這些數據進行系統(tǒng)、細致的分析。
3.4 從海量數據到“分子電影”
蛋白分子被激發(fā)之后很短的時間內,所有被激發(fā)的分子的結構變化近似相同。這好比是百米賽跑,激光脈沖作為發(fā)令槍,在10秒鐘左右,頂級選手們都接近百米終點位置。與之相對的,長時間的動力學演化,就類似馬拉松比賽,參賽選手的差距會被拉開。因此,在短時間的超快動力學過程中,被激發(fā)的分子近似認為具有相同結構。盡管如此,“剪輯師”也需要確定激發(fā)的分子所占的比例。信號提取和結構確定的過程如圖4所示。
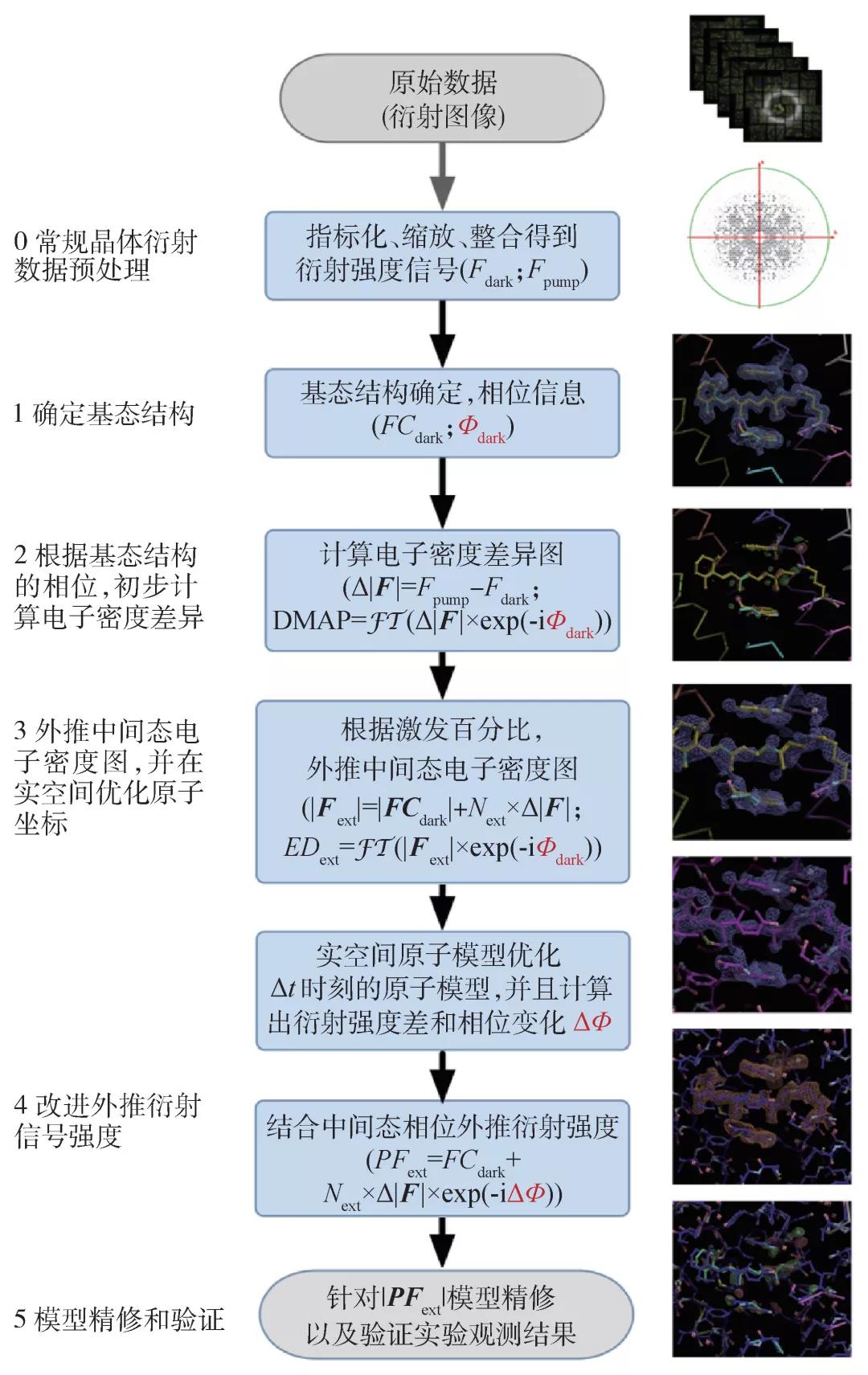
首先,確定分子的基態(tài)結構。通過測量照光之前的晶體衍射信號,利用常規(guī)的晶體衍射數據分析和相位恢復算法獲得“暗狀態(tài)”的分子結構。得益于高品質的晶體和高亮度XFEL脈沖,ClR分子基態(tài)結構的衍射信號達到了1.65 Å,精確解析出原子分辨率的蛋白結構以及氯離子、視黃醛分子、重要水分子的位置信息。至此,我們擁有了基態(tài)結構對應的X射線衍射強度和相位信息。
第二步,考慮到激發(fā)之后的結構在短時間內的結構變化很小,可以先通過基態(tài)的衍射相位信息和實驗測量的激發(fā)前后衍射信號強度的差異,計算激發(fā)前后的電子密度差異圖,確定原子位置的移動方向,初步構造對應該時刻的中間態(tài)分子結構。一旦激光照射引發(fā)某些原子位置的變化,這些原子附近的電子密度差異會出現成對的正負密度。比如,在氯離子附近就觀察到成對的正負電子密度,而且負密度信號強度達到14個標準差(標準差根據電子密度差異數值計算得出),顯示光照前后氯離子位置有顯著變化(從負密度位置向正密度位置移動)。
第三步,確定被激發(fā)分子在全部分子中所占比例。由于第二步計算實驗測量的衍射強度信號差異是一個相對的數值,光照之后還處于基態(tài)結構的分子信號被抵消,所以不能直接得出被激發(fā)分子的比例。給定時刻的中間態(tài)的電子密度圖可以按照信號線性疊加的原則,近似表達為第二步得到的電子密度差異圖與基態(tài)的電子密度圖的疊加。通過調整比例系數,觀察有顯著位置變化的原子附近區(qū)域疊加得到的電子密度的變化,從而估計出被激發(fā)的分子所占比例。比如,在ClR蛋白中,氯離子被激發(fā)后離開其基態(tài)位置,如果沒有其他原子迅速填充氯離子的基態(tài)位置,氯離子基態(tài)位置附近的電子密度則為0。我們通過將電子密度差異圖與基態(tài)的電子密度圖進行疊加,并逐漸增大密度差異圖的系數,直到指定區(qū)域的電子總數變?yōu)?,估計出“泵浦”激光對ClR蛋白的激發(fā)效率。被激發(fā)的分子占比與泵浦激光的脈沖能量緊密相關,為了避免對樣品產生附加的熱效應或者飛秒脈沖導致的多光子吸收的副產品,實驗中我們采用相對保守的泵浦激光能量,因此只有大約10%的蛋白分子被激發(fā),進入結構演化進程。這些是真正的“演員”,光照之后任意時刻測量的數據都是這10%“活躍”蛋白分子與另外90%“懶惰”基態(tài)分子的信號疊加。另外,在“泵浦”之后較長的時間里,這10%的分子將會表現出馬拉松賽道上的情形,演化速率的差異將導致更多中間狀態(tài)與基態(tài)的疊加。對于這種情形的數據分析,需要用到諸如主成分分析、奇異值分解或者機器學習等先進方法(有待后續(xù)研究)。對蛋白質分子的動力學演化過程分析可以降低分析復雜度。比如通過時間分辨的瞬態(tài)吸收光譜重構反應動力學,得出動力學時間常數(即反應速率),進而找到亞穩(wěn)態(tài)累積的時刻。這些亞穩(wěn)態(tài)的位置類似賽道上的障礙物,導致大量選手(蛋白分子)在障礙物附近聚集。用XFEL晶體學針對這些特定時刻進行測量,可以降低組分的復雜度。
第四步,根據成功激發(fā)分子的占比,計算激發(fā)后該時刻中間態(tài)的電子密度圖,并以此為約束,在實空間對原子位置進行優(yōu)化。至此,激發(fā)之后該時刻對應中間態(tài)結構的衍射強度和相位得到更準確描述。新的相位信息用于修正合成的衍射強度(對應該時刻中間態(tài)結構),將差異信號和基態(tài)結構的衍射信號在復平面進行向量疊加。在這個步驟之前,基態(tài)結構的相位被近似用于描述中間態(tài)。針對改進的衍射信號,再次優(yōu)化該時刻的中間態(tài)結構,并最終確定原子坐標和晶體結構的精修統(tǒng)計數據。
第五步,根據基態(tài)和激發(fā)后給定時刻的中間態(tài)結構,計算理論電子密度的差異圖,并與第二步得到的實驗結果進行對比分析。如二者有顯著差異,則需要再重復第四步對原子坐標進行調整。
最后,將多個結構按照時間順序串聯,就得到了具有原子分辨率的“分子電影”。
3.5 “分子電影”告訴了我們什么?
利用時間分辨的晶體衍射方法,我們獲得了0—100 ps之間5個時間點的原子分辨率結構,再現了光子驅動的氯離子輸運早期階段的ClR蛋白質動力學過程(圖5)。不同于輸運氫離子的菌視紫紅質蛋白,被輸運的氯離子在這個“分子電影”中清晰地展現了光照之后獨特的位置變化。按照以前的模型,視黃醛分子異構化導致帶正電的席夫堿朝細胞內的方向翻轉,靜電相互作用應該帶動氯離子朝細胞內移動。我們用XFEL拍攝的“分子電影”則展示了一個“脫離—擴散”的過程:視黃醛異構化之后,氯離子周圍的氫鍵網絡發(fā)生變化,釋放了被氫鍵網絡“束縛”的氯離子。經過幾十皮秒的擴散運動,氯離子被一個高度保守的蘇氨酸(Thr102)吸引,開始朝細胞內移動。這個看似違背常理的現象,是由視黃醛分子超快的異構化過程與氯離子移動時間尺度的分離導致的。根據時間分辨吸收光譜的實驗數據以及對菌視紫紅質蛋白(bR)的視黃醛異構化的研究結果,異構化在幾百飛秒之內就完成了C13=C14雙鍵的翻轉。也就是說,帶正電的席夫堿在光照之后,迅速遠離氯離子,導致二者之間的庫侖力減弱。與此同時,蛋白質還未做出響應,結構沒有發(fā)生變化,氯離子以及附近的氨基酸和水分子還處于基態(tài)位置。這就導致氯離子受力的均衡被打破,席夫堿之外的原子產生的合力“拉動”氯離子朝遠離席夫堿的方向移動(圖6)。視黃醛兩種構型(全反式和13-順式)對氯離子約束力的差異在分子動力學模擬中得到了驗證,為實驗觀看到的“分子電影”提供了支撐。

除了氯離子在100 ps之內的有趣運動之外,雖然視黃醛分子在1 ps時刻已經顯示出“13-順式”的構型,但是分子電影顯示這個異構化還處于某種震蕩狀態(tài),需要弛豫到100 ps才穩(wěn)定在“13-順式”的構型。氯離子和視黃醛分子周圍的氨基酸也隨視黃醛異構化產生了相應的結構變化,以適應新的構型。比如第98位的天冬酰胺(Asn98)在基態(tài)與氯離子形成氫鍵,其運動模式與氯離子密切相關,光照之后1—2 ps,Asn98先向胞外方向偏移,待到50—100ps又隨著氯離子向胞內方向移動。不同于“自由”的氯離子,氨基酸還連接在蛋白質的主鏈上,所以在100 ps的時候,Asn98與氯離子的氫鍵斷開。兩個色氨酸(Trp99和Trp201)自始至終為視黃醛分子提供支撐,將視黃醛包裹在ClR蛋白內部的同時,色氨酸側鏈的位置移動展示了其如何配合視黃醛構型變化。更有意思的是,氯離子附近的一個水分子在1—50 ps時刻,與氯離子保持3.5—3.8 Å的距離,維持二者的氫鍵相互作用。然而,在100 ps時,氯離子被Thr102吸引,這個水分子與氯離子的氫鍵斷開(距離超過5.7Å)。高度協調的原子位置的變化顯示氯離子輸運的動力學過程有特定的路徑,很可能是蛋白質分子長期演化過程中優(yōu)化的結果。

光照之后100 ps期間的原子位置移動主要集中在視黃醛和氯離子周邊的局部形變,而氯離子進入細胞還需要ClR分子更大范圍的結構變化。由于氯離子本身帶有負電荷,在其穿越ClR分子內部極度疏水的區(qū)域時,必然遭遇較高的能量勢壘。根據ClR分子結構和已經看到的部分“分子電影”,我們推測有兩種可能性:(1)蛋白質的七重跨膜螺旋有大尺度移動,導致細胞膜內側的結構打開更大的通道,允許水分子進入,幫助氯離子擴散到細胞內;(2)氯離子與氫離子結合,形成氯化氫分子(HCl),組團進入細胞內部,然后再水解。第一種可能性可以參照菌視紫紅質蛋白輸運氫離子的研究,在氫離子進入bR分子的時間點,第六個跨膜螺旋向外傾斜,打開了一個通道允許水分子深入蛋白內部。第二個猜測也基于一些bR輸運氫離子的模型,涉及到席夫堿質子化和去質子化的轉變。這些猜想為進一步利用XFEL研究氯離子輸運過程提供了思路,激勵我們繼續(xù)錄制“分子電影”,解密蛋白質分子如何利用太陽光輸運離子,實現能量轉化的分子機理。這100 ps的“分子電影”只是光子驅動的蛋白動力學的預告片,完整版的“分子電影”有待更深入地分析和更多的實驗研究。
4 結 語
XFEL的發(fā)展推動了諸多領域的科研工作,“損傷前探測”的實驗模式突破了輻射劑量對傳統(tǒng)成像方法的局限。利用XFEL飛秒脈沖從微米甚至納米晶體獲得原子分辨率結構的方法,不僅解析了很多重要的蛋白質分子的靜態(tài)結構,而且受益于小晶體易于激發(fā)(相對增大的表面積)而促進了時間分辨的晶體學研究(注意,同步輻射設施也可以開展時間分辨晶體衍射研究,但是時空分辨率受到限制)。本文以光感蛋白作為示例,介紹了“分子電影”的錄制過程。這個基本流程和思路也適用于以其他方法“泵浦”的分子體系,比如電壓、磁場、溫度、酸堿度、化學反應的底物分子微流混合等。其中一些方法需要克服“泵浦”的均一性和同時性的難題(即需要一個好導演)才能更好地進行“分子電影”的拍攝。我們也認識到,雖然蛋白質分子在晶體中排列相對疏松,蛋白分子間也有很多的水分子維持水環(huán)境,但晶體堆疊會影響較大尺度的結構變化,因此,分子電影的錄制,需要進一步發(fā)展單分子的高分辨成像方法。冷凍電子顯微鏡在單分子成像領域獲得了巨大的進步,如果能夠解決“攝像—導演—剪輯”三要素的問題,則有望成為“分子電影”的另一種拍攝方案[19,20]。Alphafold2在結構預測領域的突破[21],也將推動結構生物學的研究重點從對單一靜態(tài)結構的確定轉向對動態(tài)過程的研究。
最后,XFEL是造價昂貴的大型設施,需要十億甚至百億元的建設經費。盡管如此,我國從長遠著眼,提前進行了部署,在上海同步輻射設施(即上海光源)的基礎上,于2019年開工建設上海高重頻自由電子激光設施(1秒最多發(fā)射100萬發(fā)XFEL脈沖)。在不久的將來,我們將可以使用自己的XFEL光源開展尖端科學研究。