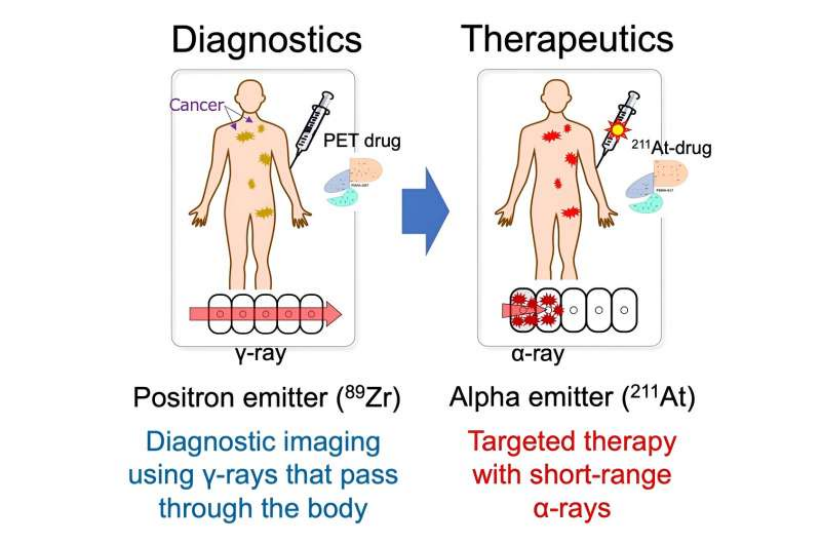
診療學概念:集診斷與治療于一體的新型醫療技術。
圖片來源:Tadashi Watabe博士(大阪大學)
胰腺導管腺癌(PDAC)是世界上最致命的癌癥之一,5年生存率低于10%。許多PDAC腫瘤無法在早期階段被發現,因為常規的成像方法包括fluorodeoxyglucose正電子發射斷層掃描(PET))無法發現它們。為了更有效地對抗這種癌癥,由大阪大學研究人員領導的一個團隊正在將診斷和治療程序結合成一個單一的綜合過程,即診療學。
在最近發表在《Journal of Nuclear Medicine》上的一篇文章中,該團隊開發了一種放射診療策略,使用一種新的放射性抗體來靶向glypican-1 (GPC1),一種在PDAC腫瘤中高度表達的蛋白質。診療學,特別是放射診療學,已經受到越來越多的關注,因為通過放射標記用于靶向癌細胞中某些分子的化合物,診斷和治療可以依次進行。
該研究的主要作者Tadashi Watabe博士解釋說:“我們決定以GPC1為靶點,因為它在PDAC中過度表達,但在正常組織中僅低水平存在。”
該團隊使用了一種針對特定分子的單克隆抗體(mAb)來靶向GPC1。該單克隆抗體可用放射性鋯(89Zr)或放射性砹(211At)來標記。他們研究了異種移植小鼠模型,將人胰腺癌細胞注射到小鼠體內,使這種腫瘤發展成可以通過實驗治療和監測的完整腫瘤。給這些小鼠靜脈注射的為89Zr標記的GPC1 mAb。同時給予211At標記的GPC1單克隆抗體,以檢測其抗腫瘤作用。

靶向glypican-1 (GPC1)的診療:
(左)使用胰腺癌模型小鼠(紅色箭頭表示腫瘤)進行Zr-89標記的GPC1抗體的PET成像;
(右)使用At -211標記的抗GPC1抗體對胰腺癌模型進行α放射治療。
圖片來源:Tadashi Watabe 博士(大阪大學)
本文第二作者Kazuya Kabayama解釋道:“我們通過PET掃描監測了7天內89Zr-GPC1 mAb的內化情況。mAb在腫瘤中有很強的攝取,這表明這種方法可以支持腫瘤的可視化。我們證實,這是由其與GPC1的結合介導的,因為GPC1表達被敲除的異種移植模型顯示出明顯較低的攝取。
研究人員接下來使用211At-GPC1 mAb的α療法對這一模型進行了測試,該方法可以支持基于放射性標記的治療分子遞送至靶點。211At-GPC1 mAb可誘導腫瘤細胞DNA雙鏈斷裂,并顯著抑制腫瘤生長。對照實驗表明,當mAb內化受阻時,這些抗腫瘤作用不會發生。此外,未放射性標記的GPC1 mAb沒有誘導這些效應。
Tadashi Watabe博士說:“我們研究的兩種放射性標記的GPC1 mAb在PDAC中都顯示出可喜的結果。89Zr-GPC1 mAb顯示出高腫瘤攝取,而211At-GPC1 mAb可用于靶向α治療,以支持抑制PDAC腫瘤生長。"
這些極具影響力的數據證明了在PDAC中使用診療方法的潛力,這是一種迫切需要新的診斷和治療方案的疾病。未來,有望通過PET成像實現PDAC的早期檢測,并使用α療法進行全身治療。