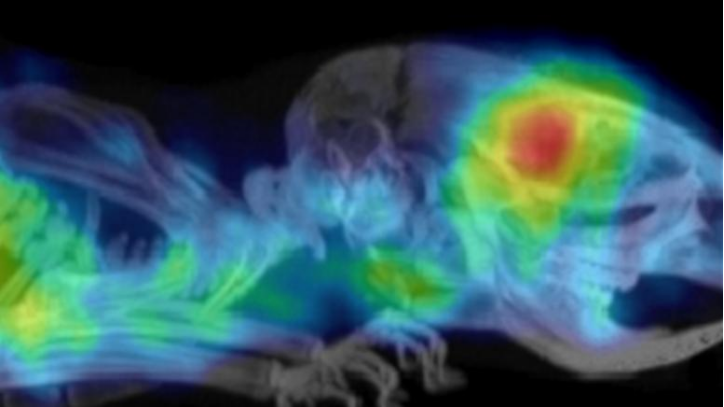
上圖為小鼠模型中的膠質母細胞瘤的PET掃描圖像,圖片來源: ICR的臨床前分子影像團隊
一種新的篩查方式可能通過幫助確定哪些腦瘤患者最有可能從某些治療中獲益,從而提高快速增長的腦瘤患者的生存率。
在小鼠模型上進行的創新臨床前研究表明,一種分子成像技術可以揭示膠質母細胞瘤中一種名為PD-L1的蛋白質的存在,膠質母細胞瘤是成人中最常見的癌癥腦瘤類型。
檢測高水平PD-L1的方法有助于指導治療決策,再配合其他措施,從而可能改善患者的預后。
評估PD-L1表達水平
目前,科學家們通過對手術期間患者的組織樣本進行免疫組化來評估PD-L1表達水平,這是膠質母細胞瘤的一線治療方法。然而,這項技術容易受到人為錯誤的影響,而且對于這些患者或這種特定的腫瘤,這種技術在全球范圍內沒有標準化,結果也很難量化。
美國癌癥研究所的研究人員表示,一種稱為免疫-正電子發射斷層掃描(immuno-PET)的非侵入性成像技術可能是一種更好的方法。
這項研究已發表在《Cancers》雜志上。該研究主要由ICR資助,ICR既是一個研究機構,也是一個慈善機構;部分由ICR的英國癌癥研究融合科學中心、倫敦帝國理工學院和波蘭國家科學中心資助。
免疫治療可能改善膠質母細胞瘤的治療前景
膠質母細胞瘤始于大腦細胞的生長。它生長迅速,通常在大腦內擴散,因此很難有效治療。目前尚無治愈方法,最初對治療有反應的患者往往會復發。平均生存時間只有12-18個月,只有5%的患者生存超過5年。
近幾年來,免疫療法已經顯示出治療膠質母細胞瘤的潛力。特別是,研究人員一直在測試一種被稱為免疫檢查點抑制劑的藥物,這種藥物可以阻止其他蛋白質抑制身體的免疫反應。迄今為止的結果好壞參半,表明該療法可能只對一部分患者有效。
創造一種新型放射性示蹤劑
ICR的團隊成功地使用NOTA-maleinide將高親和力ZPD-L1分子與氟-18和鎵-68放射性核素連接起來。親和體是一種小蛋白質,可以與靶蛋白緊密結合(本例中的PD-L1)。這一過程產生了18F-AIF-NOTA-ZPD-L1和68Ga-NOTA-ZPD-L1,具有高特異性,能夠識別腫瘤細胞及其微環境中的PD-L1。
研究小組選擇使用親和體而不是抗體,因為親和體的體積小得多,意味著它們可以更快地被身體代謝,減少患者的輻射劑量,并防止手術延誤。使用親和體還可以在注射后1小時獲得高質量的圖像。相比之下,當使用抗體時,圖像通常要在48小時后才能獲得。
嘗試新方法
研究人員證明,這些放射性標記的親和體可用于評估小鼠腫瘤中PD-L1的表達水平。PET掃描顯示,雖然在健康組織中有一些放射性示蹤劑的攝取,但高腫瘤/本底對比度使腦腫瘤清晰可見。
然后,研究人員調查了36例新診斷為膠質母細胞瘤患者的樣本。他們在39%的樣本中發現了PD-L1陽性膜染色。對161例人類膠質母細胞瘤樣本進行的另一項分析證實,與其他膠質母細胞瘤亞型相比,具有間充質特征的腫瘤PD-L1表達水平顯著升高,這與其對免疫檢查點抑制劑的更好反應有關。該結果支持了以下觀點:醫療專業人員可以使用immuno-PET來識別最有可能從免疫檢查點抑制劑中獲益的患者。
“非常令人興奮”
研究人員希望這項工作將為30% - 49%的間充質亞型膠質母細胞瘤患者帶來更好的結果。他們目前正在波蘭進行一項臨床試驗,該試驗建立在這項臨床前研究的基礎上,并希望在不久的將來能夠展示該試驗的數據。
ICR的臨床前分子成像小組組長Gabriela Kramer-Marek博士說: “見證從實驗室到臨床的過程真的很令人興奮。我們目前正在進行一項人體臨床試驗,之所以它能成為可能,得歸功于這項有希望的臨床前工作。該項試驗是有史以來第一次使用immuno-PET來評估原發性膠質母細胞瘤患者的PD-L1,我們希望圖像能清楚地顯示PD-L1在這些腦腫瘤中的存在。
“膠質母細胞瘤的治療方法幾十年來未曾改變。雖然我們還沒有找到治愈的方法,但我相信這種新型篩查方法肯定會改變患者的預后。”