基于成纖維細胞活化蛋白(fibroblast activation protein, FAP)靶點的放射性核素標記診療探針的研發是近年來核醫學及放射性藥物領域的熱點,代表了放射性藥物的下一個前沿領域。遺憾的是,包括FAPI-02、FAPI-04及FAPI-46等在內的喹啉類FAPI探針在動物模型和受試者中顯示出血液清除較快、腫瘤滯留不佳的特性,極大限制了其作為診療探針的進一步應用。近期,廈門大學分子影像中心、廈門大學附屬第一醫院及新加坡國立大學等多團隊合作,連續報道了多項針對FAP靶點的放射性核素標記小分子探針的研發工作(J Nucl Med. 2022,63:862-868; Theranostics 2022,12:422-433; J Med Chem. 2022, doi: 10.1021/acs.jmedchem.1c02162)。
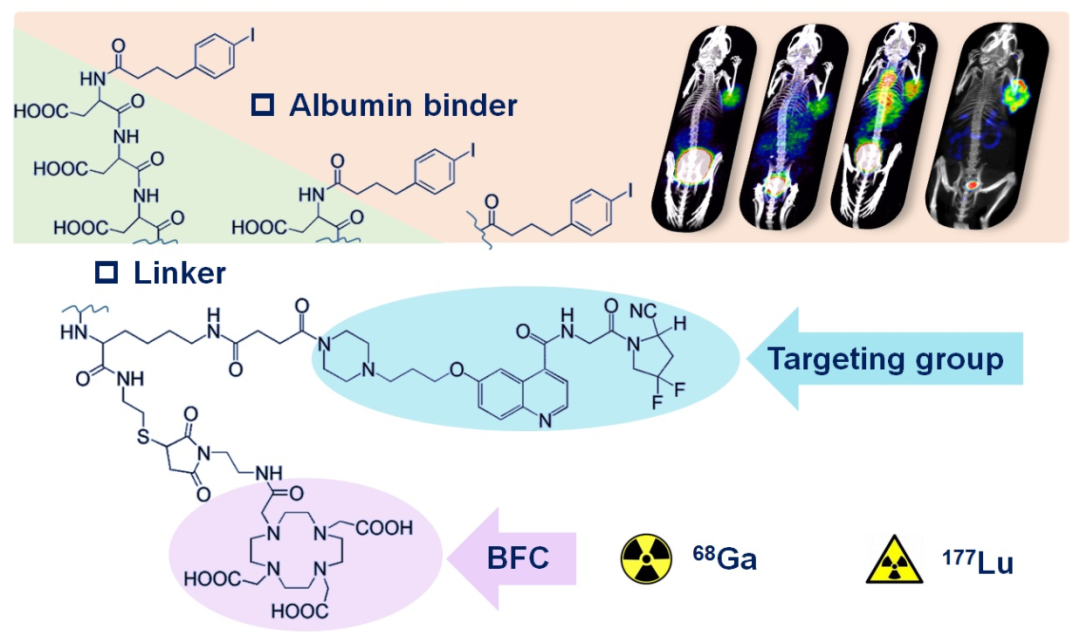
近日,該合作團隊在藥物化學期刊J Med Chem上發表了題為“Rational Design and Pharmacomodulation of Protein-Binding Theranostic Radioligands for Targeting the Fibroblast Activation Protein”的研究論文。基于在4-(P-碘苯基)丁酸類(IPBA)修飾探針方面的積累,研究者通過引入IPBA蛋白親和結構并調控連接劑Linker重復單元進一步對68Ga/177Lu核素標記的FAP靶向探針的藥代動力學性質進行優化。在肝癌人源腫瘤異種移植小鼠模型(HCC-PDX)中的成像測試結果表明:經尾靜脈注射之后,放射性探針在腫瘤中快速聚集。IPBA結構的引入延長了探針的血液循環時間,使之在腫瘤部位具有更高攝取及更長滯留。值得一提的是,基于親水性肽段的調控策略,可提供不同藥代動力學性質的分子探針選項,具有更強的針對性和選擇性。研究人員發現:親水性肽段的引入可有效降低FAP靶向探針在非靶部位的滯留,提高靶/非靶比值。在該文章中,所篩選的68Ga/177Lu核素標記的FSDDnI系列探針,相比于FAPI-04而言,在腫瘤攝取及滯留方面具有非常顯著的提升。其中,帶ASP三肽Linker的68Ga-FSDD3I體現出綜合優勢,在候選化合物中具有最高的靶/非靶比值。此外,該團隊之前的另一項基于伊文思藍(truncate-Evans Blue, EB)修飾的FAP靶向探針的研究(Xuejun Wen, et al. Theranostics 2022, 12:422)結果顯示:微型PEG間隔基團的長度亦可直接影響探針的血液循環時間及其在非靶器官的信號值。當使用不同長度的PEG2-PEG6作為Linker連接FAP靶向基團及EB時,腫瘤/肝臟及腫瘤/腎臟的比值均有不同程度的下降。
這一系列研究旨在助力攻克FAP靶向探針所面臨的應用及轉化壁壘,揭示不同功能基團修飾策略對探針藥代動力學性質的調控規律,對相關診療探針的開發具有借鑒價值。廈門大學分子影像中心郭志德博士及張現忠教授、新加坡國立大學陳小元教授和廈大附屬第一醫院陳皓鋆博士為該文章的共同通訊作者,廈門大學碩士生孟令欣、博士生方建陽、趙亮為該文章的共同第一作者,該研究得到了國家自然科學基金、廈門大學南強青年拔尖人才支持計劃、廈門大學校長基金等項目的資助。