前文介紹了PET/CT放療定位在頭頸部腫瘤中的應用,本期我們來看下PET/CT如何助力食管癌精準放療。由于食管癌早期無明顯特征,大多數患者確診后往往已處于中晚期。放療聯合同步化療是臨床治療食管癌的常用方式,尤其是對于不可手術的局部晚期食管癌或局限于區域淋巴結轉移的病變。
PET/CT在食管癌精準放療中發揮著重要作用,包括食管癌原發腫瘤和累及區域淋巴結的精確勾畫,以及對治療反應和預后的有效評估等。武漢大學中南醫院核醫學科和腫瘤放化療科聯合,針對頭頸部腫瘤、食管癌、肺癌和宮頸癌等率先在湖北省內開展了三維適形和三維調強放射治療技術的研究。
下述病例為食管非角化型鱗狀細胞癌術后1月余,患者為求進一步診治,于中南醫院核醫學科Biograph mCT設備上行18F-FDG PET/CT放療定位掃描。
PET/CT圖像顯示左側鎖骨上區、右肺門、降主動脈右前方、T8椎體前方、右側第6后肋旁多發腫大淋巴結,代謝異常增高,考慮轉移性病變。
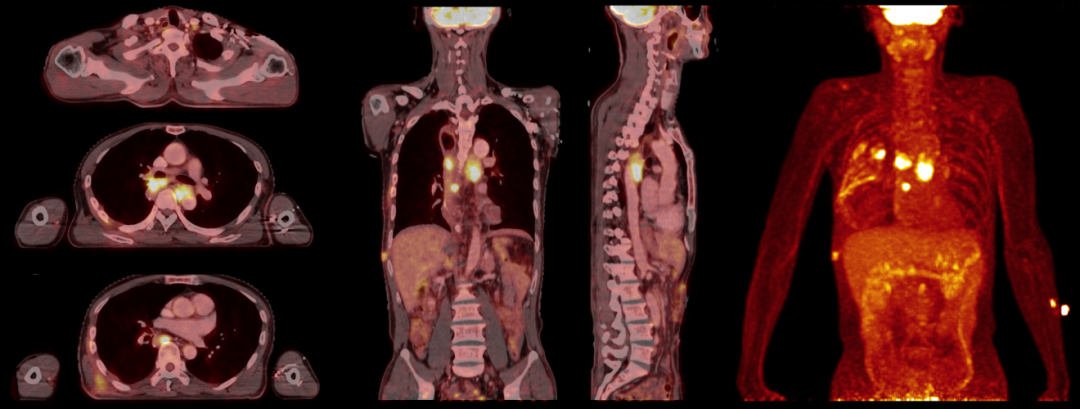
患者有放化療指征,無明顯放化療禁忌,腫瘤放化療科依據PET/CT放療定位圖像精準勾畫靶區后行縱隔放療(Dt=50.4Gy/28F) ,同時行兩周期DF方案同步化療(氟尿嘧啶+順鉑)。

放療術后兩月行18F-FDG PET/CT復查,復查圖像顯示全身未見明顯FDG代謝異常增高,腫瘤糖酵解總量(TLG)由157.30降為0,提示完全代謝緩解。

感謝武漢大學中南醫院提供病例
PET/CT在食管癌精準放療中發揮著重要作用,包括食管癌原發腫瘤和累及區域淋巴結的精確勾畫,以及對治療反應和預后的有效評估等。臨床上一般會基于CT增強定位圖像并參考PET/CT定位圖像,或基于CT增強與PET/CT的配準圖像進行靶區勾畫。將PET/CT應用于放療定位中,是為了綜合考量食管癌患者原發病灶、區域淋巴結受累和遠處轉移情況,以精確勾畫靶區。
單純使用CT的形態學特征進行食管癌靶區的勾畫存在一定誤差,因CT無法準確地區分腫瘤與炎癥組織,以及與食管壁有密切關聯的腫大淋巴結等,而且食管在解剖上毗鄰心臟、肺等,放療過程中會對正常心臟組織造成一定的損傷,且影響患者肺功能,導致放射性肺炎、放射性氣管炎等并發癥。
將PET/CT應用于食管癌放療定位中,依據代謝影像與解剖影像的融合,可以提高靶區勾畫的準確性并優化治療計劃,最大可能給予靶區高劑量的同時給予危及器官低劑量,同時有效降低不同醫師間靶區勾畫的差異,以此來提升治療效果,減少并發癥[1]。
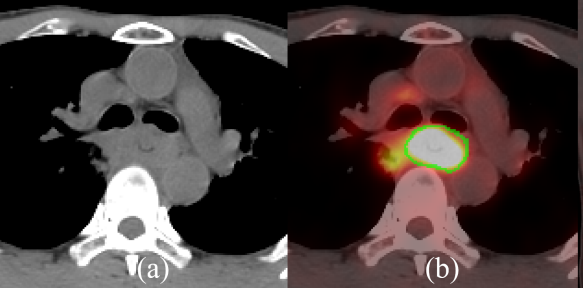
與CT相比,PET/CT可更為準確地勾畫食管癌原發腫瘤灶(綠線為真實腫瘤邊界)[2]
食管癌靶區勾畫中另一個重要的內容是確定淋巴結轉移范圍。食管癌具有高淋巴結轉移率,其轉移模式難以預測。當前CT診斷標準是按照受累淋巴結直徑范圍來判斷淋巴結是否出現轉移,但是僅依據形態學特征進行轉移淋巴結的診斷存在一定的誤差。
18F-FDG PET/CT能夠有效提高轉移淋巴結診斷的準確性,其轉移淋巴結探測的敏感性達74.7%,特異性達97.2,準確性達92%,均優于單獨CT[3]。將PET/CT應用于食管癌放療定位中,對于區域淋巴結照射體積及范圍的精確確定,減少轉移淋巴結的漏照十分關鍵。
術前新輔助放化療(nCRT)是局部晚期食管癌患者的首選治療方法。術前放化療通過阻斷血行和淋巴結轉移來改善預后,同時也縮小了原發腫瘤的大小以提高手術切除率[4]。研究發現nCRT后達到病理學完全緩解(PCR)的患者,無論是否接受后續的手術切除,預后均相對較好;而在nCRT中無反應的患者即使接受完全的手術切除,預后也可能很差[5]。
因此,準確評估食管癌患者nCRT后的治療反應具有重要的臨床價值,對于病理學完全緩解的患者,可以避免不必要的手術切除,而對于治療中無反應的患者,則可能減少不必要的放化療副作用,指導后續治療策略的制定。
傳統的CT和內鏡超聲等形態學檢查無法準確地從放療導致的瘢痕、水腫和纖維組織中將殘留的腫瘤組織鑒別出來,PET/CT等功能學影像則能夠更為全面地反映腫瘤的的生物學特征,在形態學變化之前提供腫瘤代謝活性變化的信息[6]。2021年Xu的一項最新研究顯示18F-FDG PET/CT有助于食管癌患者nCRT后的再分期,并與DW-MRI結合,可更為準確地評估食管癌原發腫瘤對于nCRT的病理反應[7]。
該項研究回顧了51例病理確診的局部晚期食管鱗癌患者,在nCRT前和nCRT后4-6周分別進行了兩次18F-FDG PET/CT全身掃描,以兩次PET/CT掃描各項代謝參數的變化與手術切除術后病理標本進行對照,以探究PET/CT在食管癌nCRT治療反應評估中的價值。
該研究顯示在原發腫瘤病理完全緩解(pCR-T)組和non-pCR-T組之間,nCRT后PET/CT檢查得到的SUVmax、MTV、TLG參數有顯著性差異,并且前后兩次PET/CT檢查SUVmax和MTV參數的變化也有顯著性差異。

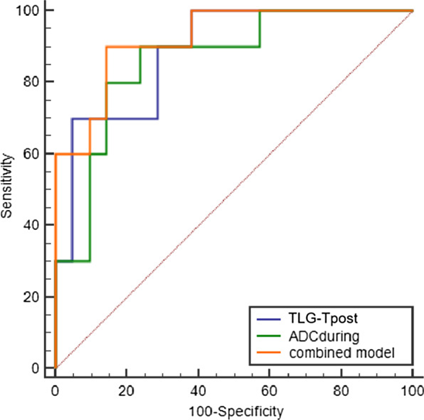
通過ROC分析將PET/CT檢查得到的各項代謝參數用于預測食管癌原發腫瘤nCRT后的治療反應,顯示nCRT后PET/CT檢查得到的TLG具有最好的預測價值(AUC=0.828),并且將TLG參數與DW-MRI掃描獲取的表觀擴散系數(ADC)結合,可以提高食管癌nCRT療效評估的準確性(AUC=0.914),TLG與ADC結合預測食管癌nCRT病理反應的敏感性和特異性分別為90%和86.36%。
此外,2019年Kim的一項研究顯示食管癌患者放化療術后18F-FDG PET/CT顯示的早期代謝反應可以準確預測患者的復發和預后[8]。該研究回顧了21例病理確診的食管癌患者,在放化療術前(within 30d)和術后(9-12d)分別進行了18F-FDG PET/CT全身顯像,并對所有患者進行了平均為期13.1個月的隨訪(1.6-23.6月),通過兩次PET/CT掃描獲取的代謝參數評估其在食管癌放化療術后復發及預后中的價值。
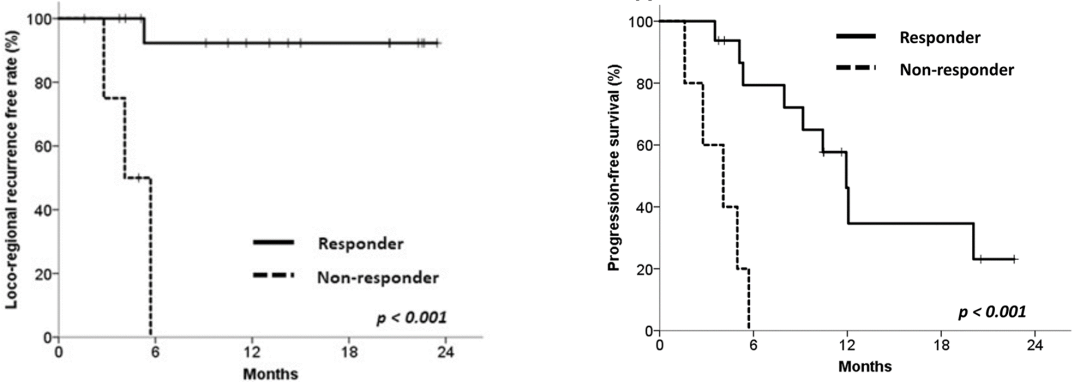
研究顯示兩次PET/CT掃描間MTV的變化與食管癌放化療術后局部復發密切相關(p=0.03),而SUVmean的變化與遠端轉移密切相關(p=0.02)。以1.14 (MTV PET2/MTV PET1)作為閾值來判斷食管癌放化療術后是否為病理完全反應,可以看到治療反應組和無反應組的1年無局部復發率(Loco-regional recurrence free rate)有顯著性差異(92.3 vs 0%),并且,治療反應組顯示出更長的無進展生存期(Progression-free survival)和更高的1年無進展生存率(34.6 vs 0%)。
精準的放療定位和療效評估離不開先進的技術和設備。西門子醫療和業界知名的放療設備司瓦里安醫療強強聯合,為臨床從診斷到治療到隨訪,提供診治一體化精準放療最完整的解決方案。
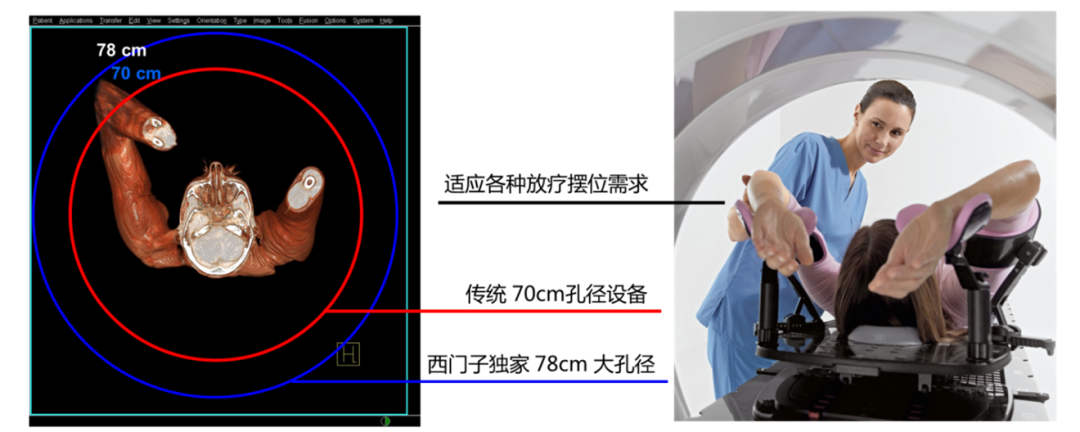
業界獨家78cm大孔徑
西門子采用業界獨家的78cm大孔徑PET/CT,相比于傳統70cm孔徑,78cm大孔徑短機身一體化的設計,提升了約25%的孔徑內空間。25%的孔徑內空間提升一方面可以滿足更大體型,特別是肥胖人群的日常掃描需求,提高了患者檢查的舒適度;另一方面,更大的有效視野和擺位空間也滿足了放療定位時的多種擺位要求。
西門子PET/CT不僅僅是PET系統的大孔徑,更是PET與CT一體化的78cm大孔徑,這使得該設備還可作為單獨的CT模擬機使用,一次患者掃描獲得PET/CT與CT增強定位圖像,極大地減少了兩組圖像間患者的體位誤差,靶區勾畫結果更為準確。
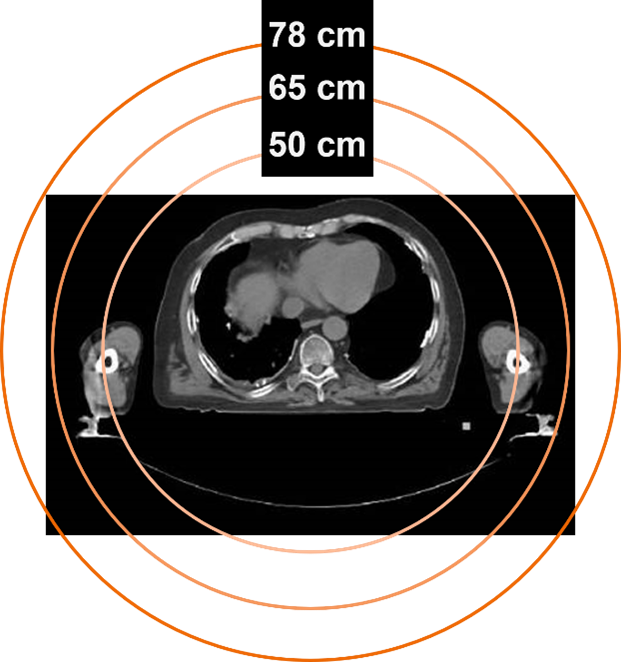
78cm HD高清視野(FOV)
基于獨家的78cm大孔徑,西門子推出了78cm HD高清視野(FOV)重建技術,與傳統的50cm CT重建視野相比,實現了全CT視野可見,能完全覆蓋所有人群的全部身體部位,同時完全兼容各種外展位、大體積放療支架等。
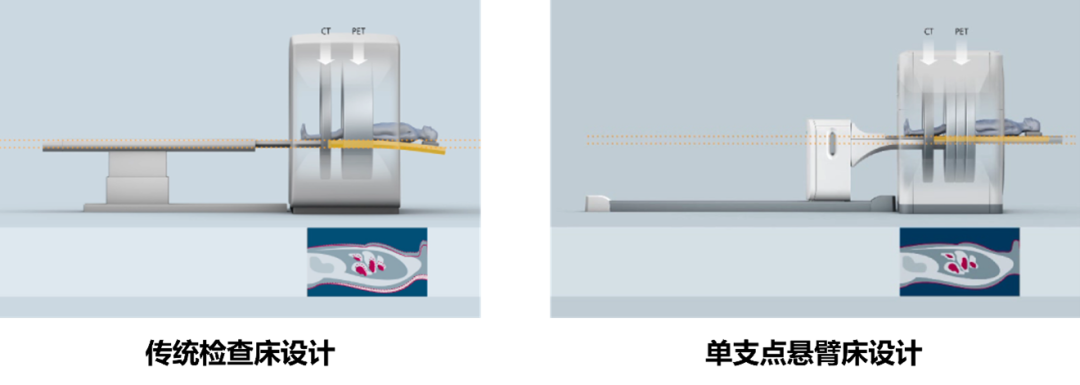
西門子采用磁懸浮驅動、單支點懸臂式檢查床,保證了PET與CT掃描時檢查床保持等力臂移動,消除了常規檢查床使用床板延伸式時所導致的移動偏差,實現了PET圖像與CT圖像的精確配準。此外,西門子磁懸浮單支點檢查床是業界唯一符合TG66標準的檢查床,同時可提供原廠專業放療定位床板,保證了最精準的放療定位精度。
獨家ALPHA人工智能引擎
在放療療效評估過程中,為觀察病灶的變化,需要醫師進行多個時間點圖像的比較,因此需要圖像之間的同軸配準。傳統的配準方法是逐像素進行的,然而當兩次檢查的視野、患者姿勢(如:手臂舉起VS手臂放下)或檢查床設置(如:厚床墊VS薄床墊)發生變化時,傳統算法會失效,錯誤的配準可能導致病灶消失的假象。
西門子ALPHA人工智能引擎基于專利的器官識別技術進行解剖學配準,使醫師更便捷的對比不同檢查的數據。該技術在每幅圖像中探測多達28個解剖學標識,基于解剖一致性檢查進行過濾,并利用重疊標識對不同時間點的圖像進行配準。由于ALPHA配準是以解剖結構識別為基礎的,就像人工進行圖像配準一樣,而不是低水平的像素匹配,不受前述所有變化的影響,實現了不同時間點PET/CT圖像的精確配準。
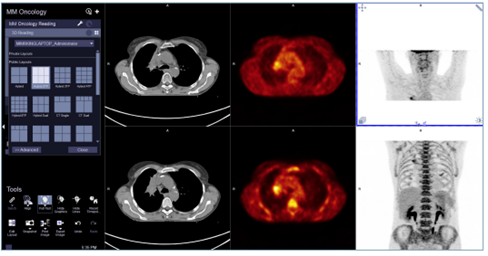
ALPHA配準可對多時間點的檢查圖像進行匹配,即使它們有不同的FOV
MFS多病灶分割
準確的療效評估源自規范化的測量方法。根據指南,對同一患者進行PERCIST標準評估,需測量全身所有病灶并選出代謝最高的5個病灶進行計算。此外,對于肝臟或主動脈區域的參考值測量也有相應的規定。
西門子推出的MFS(Multi-Foci Segmentation)多病灶分割軟件能夠根據PERCIST標準的要求自動標記肝臟或者主動脈區域的參考VOI,自動識別、分割全身病灶VOI并篩選出用于評估療效的5個病灶,根據這些病灶的多種定量指標(SUV、MTV、TLG)自動計算結果,給出療效評估等級(完全代謝緩解、部分代謝緩解、疾病穩定、疾病代謝進展)。
使用MFS多病灶分割可減少操作者的主觀依賴性,提高臨床工作效率,并提供精準、客觀的療效評估及預后評價所需參數,為臨床工作及科研提供高效、準確的解決方案。
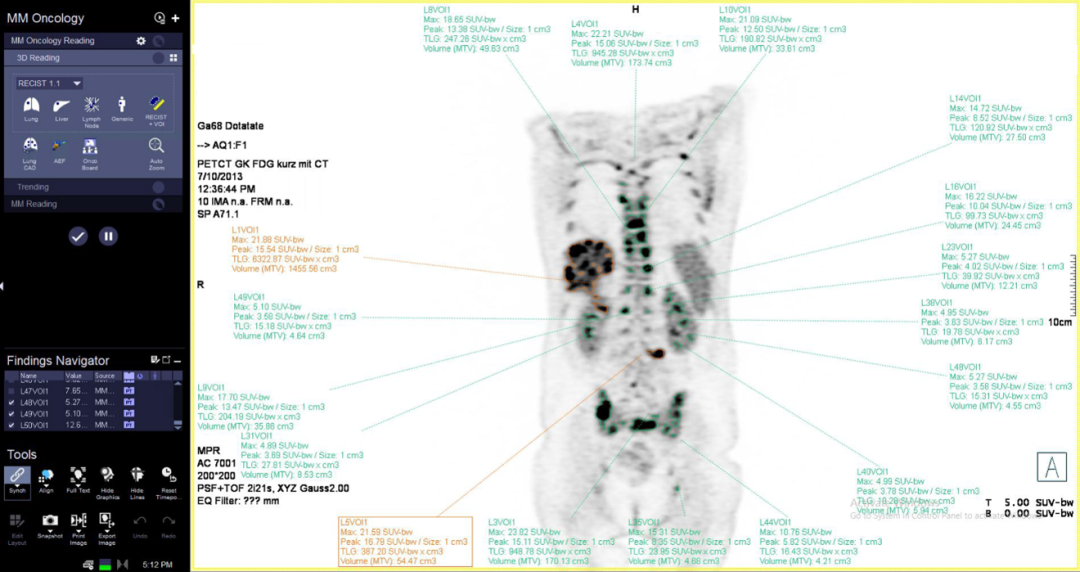
SUV作為一種半定量參數,在不同設備或不同重建參數下存在較大差異,可達-54%~+86%,而根據實體瘤療效評價標準(Percist),對于療效評估的SUV偏差閾值是需要控制在±30%以內。多個時間點圖像中SUV的較大差異限制了Percist標準的應用,使得療效評估結果準確性無法得到保證,而準確的放療療效評估對腫瘤患者的后續治療方案選擇及隨訪監測方案至關重要。