在腫瘤治療領域,科學家們不斷探索和開發更有效、毒性更低的創新療法,以提高局部腫瘤控制率、患者存活率和生活質量。硼中子俘獲療法(BNCT)是幾十年前提出的一種創新的放射治療方法,從理論上講,它可能是許多類型癌癥的理想治療方法。首先,為患者注射含硼(Boron)藥物,藥物和癌細胞有很強的親和力,并很快聚集在腫瘤細胞內,而很少在正常組織中聚集。然后對患者的腫瘤部位進行熱中子(thermal neutrons)照射。當熱中子被腫瘤細胞中的10B俘獲時發生裂變,產生了破壞力較大的α粒子和反沖的7Li核,可以精確地殺死腫瘤細胞。
BNCT選擇性殺傷腫瘤細胞的機制
BNCT是一種基于硼中子俘獲的裂變反應。非放射性同位素10B原子通過吸收低能(<0.5eV)中子(熱中子)分裂成α粒子(4He)和反沖核(7Li),這些粒子在短距離(<10μm)內釋放能量。而單個細胞的大小約為10μm,所以硼中子俘獲反應發生于單個細胞內。從理論上講,10B可以選擇性聚集在惡性腫瘤細胞中,利用上述反應產生的兩種重粒子(4He和7Li)選擇性地殺死腫瘤細胞,同時保護正常組織免受損害。(圖1&圖2)。
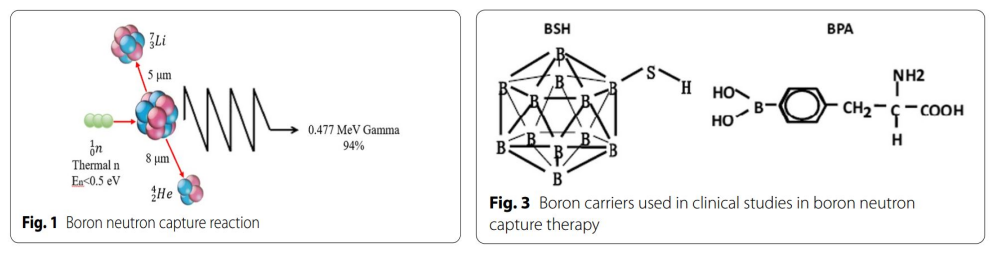 圖1:硼中子俘獲反應的原理;圖3:BSH和BPA的結構
圖1:硼中子俘獲反應的原理;圖3:BSH和BPA的結構
BNCT的基本放射生物學因素
在BNCT中,三種具有不同線性能量傳遞(LET)特性的直接電離能傳遞給腫瘤和正常組織,它們是:
(a)硼中子俘獲反應產生的高LET的 α粒子和7Li離子:10B+1n=7Li+4He(α)+2.79 MeV;
(b)中子束及氫中子俘獲反應中產生的低LET γ射線:1H+1n=2H+γ+2.2MeV;
(c)快中子散射和氮原子俘獲熱中子產生的高LET質子:14N+1n=14C+1p+580keV。即使物理劑量相同,高LET和低LET粒子的生物效應也不同。在相同的物理劑量下,由于沿軌道的電離密度較高,高LET粒子比低LET粒子產生更強的生物效應。這通常被稱為相對生物效應,類似于參考放射源(如X射線)的吸收劑量與產生相同生物效應的其他放射源的吸收劑量之比。33541640944354300
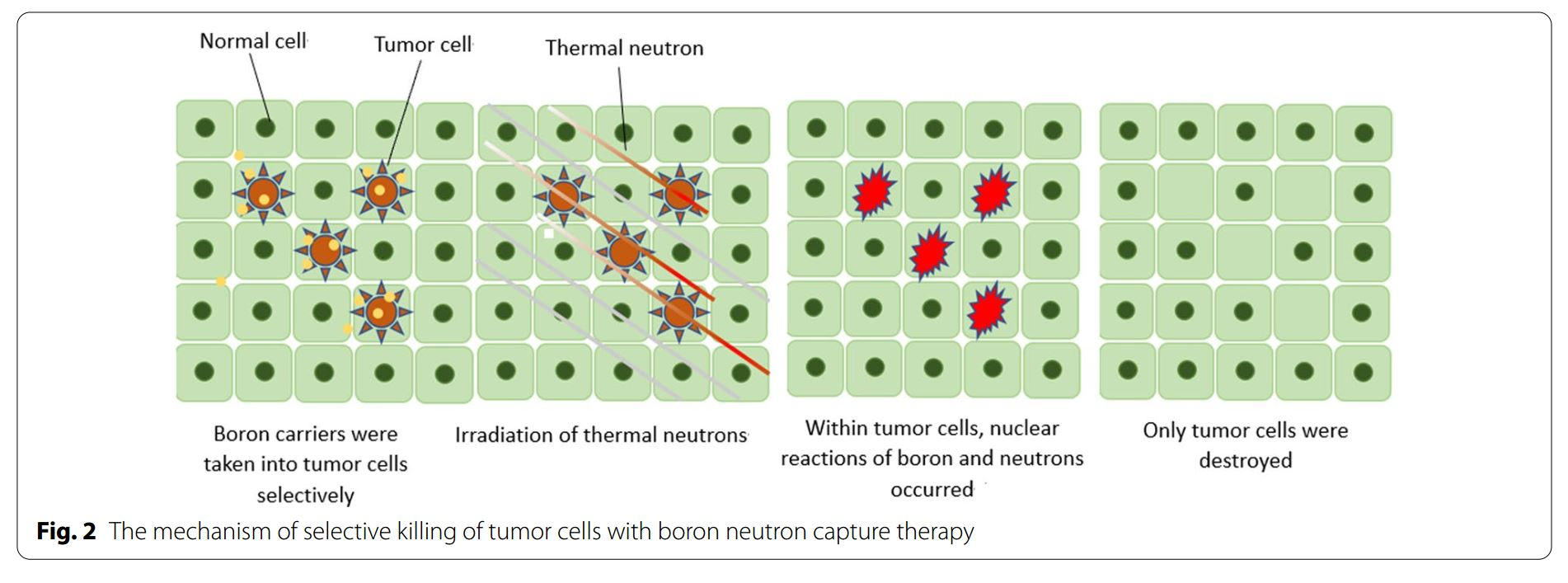 圖2:BNCT選擇性殺傷腫瘤細胞的原理
圖2:BNCT選擇性殺傷腫瘤細胞的原理
硼的載體
BNCT殺滅腫瘤細胞的兩個重要因素是10B和熱中子。其中最重要的是10B濃度較高且選擇性進入腫瘤細胞。在研制硼載體時需要考慮以下三個重要因素:
(1)腫瘤組織中10B的濃度范圍達到20-35μg 10B/g;
(2)腫瘤/正常組織10B濃度比和腫瘤/血液10B濃度比大于3-5;
(3)足夠低的毒性。然而,目前還沒有一種硼載體能完全滿足上述要求。
在20世紀50年代至60年代初,BNCT的發展處于初級階段,研究者使用硼砂、硼酸及其衍生物作為硼載體進行了初步的臨床研究以評價BNCT對腦腫瘤的療效。Farr等首次使用硼砂作為硼載體,對GBM患者進行BNCT。但該研究并未成功,這是由于第一代硼載體不具有腫瘤特異性,中子照射后正常組織受損嚴重。且腫瘤細胞內硼濃度不足。隨后,研究者致力于開發具有腫瘤細胞選擇性的硼載體。硼苯丙氨酸(BPA)和硼碳酸鈉(BSH)脫穎而出,發展成為第二代硼載體。BPA由Synder等合成,其結構與酪氨酸類似,參與特定蛋白質的合成,因此在腫瘤的快速增殖過程中選擇性積聚于腫瘤生長相關的蛋白質中,從而選擇性聚集于腫瘤細胞。BPA對腦腫瘤有效,因為除腫瘤細胞外,腦內很少有增殖活躍的細胞。將BPA與果糖結合(BPA-F)可顯著提高BPA在生理pH下的水溶性,進一步提高進入細胞的能力。BSH由Solow等在1967年合成,并證實其具有腦腫瘤特異性。BSH通常含有10個及以上的硼原子,在日本等國家開展了多項針對膠質瘤的臨床研究。
由于BPA主要針對增殖的腫瘤細胞,且在腫瘤細胞中產生更高的硼濃度,因此較BSH具有更大的腫瘤殺傷能力和更小的副作用。BPA和BSH聯合應用,可使硼的分布更均勻,以獲取更好的療效。另外,改善給藥方式,如同時輸注甘露醇,采用聚焦超聲技術,或通過對流增強輸送裝置進行瘤內給藥,可顯著提高腦腫瘤對BPA和BSH的攝取能力。另外,利用18F標記的BPA可通過PET置管顯示10B在人體內的分布,為制定BNCT治療方案提供指導。目前,BPA是治療高級別膠質瘤和復發頭頸部腫瘤的首選硼載體,第二代硼載體代表了BNCT技術發展的里程碑。
第二代硼載體由于分子特性存在缺陷,并不是理想的硼載體。隨著越來越多的研究者投入硼載體的研發,第三代硼載體顯示出旺盛的生命力。第三代硼載體分為兩類:含硼小分子藥物和含硼納米藥物。含硼氨基酸衍生物是很有前途的小分子硼載體,可通過氨基酸代謝途徑實現腫瘤特異性。從BPA和18F-BPA衍生出多種新型的硼載體。Nomoto等將BPA與聚乙烯醇結合(PVA-BPA),增強腫瘤攝取,提高療效。Li等合成了一種新型的硼化酪氨酸FBY,18F-FBY具有較強的代謝穩定性,且腫瘤特異性較高,是具有較大潛力的PET顯像用硼載體。在納米載體方面,含硼膠束是近年來研究的熱點。嵌段共聚物(Block Copolymer)在水中可以自組裝成球形的核殼聚合物膠束。它們制備簡單,生物相容性高,穩定性好,水溶性強。與PEG共聚可有效延長血液循環時間,被廣泛應用于藥物成像和靶向遞送。Sumitani合成的含硼聚乙二醇聚乳酸延長了血液循環時間,并顯示出高腫瘤攝取率,且制備簡單,具有較好的臨床應用前景。Shi等利用MPEG-PLGA膠束包覆硼卟啉TBPP。制備了含硼納米藥物BPN。膠束包衣不僅將TBPP從血細胞中分離出來,降低藥物毒性,而且提高了腫瘤特異性,克服了傳統含硼卟啉的缺點。BPN的藥代動力學也可以通過熒光成像和PET成像來研究,以便于開發治療方案。
硼的來源
1、反應堆中子源
根據能量大小,核反應堆中產生的中子可分為熱中子(慢中子)(En<0.5 eV)、超熱中子(0.5 eV10keV)。熱中子是BNCT中最重要的中子源,可以參與硼中子俘獲反應。現有BNCT研究中,均利用了反應堆中子源。但反應堆的前景不樂觀,其造價高,占地面積大,運維費用高,改造難度大,有些已經關停或面臨關停風險。專為BNCT研發的新一代反應堆中子源可解決此項問題,例如在我國北京建設的一個低功率反應堆,該反應堆成本較低,安全性高,可在醫院內部使用。
2、基于加速器的BNCT中子源(AB-BNCT)
通常,質子或氘離子首先由加速器加速,然后用鋰或鈹靶轟擊,通過裂變產生中子。對于AB-BNCT來說,最有希望的核反應是用2.5 MeV的質子轟擊7Li靶,產生中子的最大能量和平均能量分別為0.8 MeV和0.4 MeV,比反應堆產生的中子能量低。
目前正在探索多種不同類型的中子源加速器,如低能直線加速器、高能回旋加速器、高能直線加速器和高能同步加速器在BNCT中的應用。與反應堆中子源相比,AB-BNCT有許多優點:
(a)當不需要中子源時,加速器容易關閉。而反應堆遺留大量的永久性放射性物質;
(b)加速器較反應堆更容易獲批建造;
(c)易于安裝和維護;
(d)費用較低;
(e)放療科對加速器的使用經驗豐富。
(f)加速器產生的中子源的質量遠遠高于反應堆產生的中子源的質量。
 圖4:中國自主生產的基于加速器的BNCT裝置
圖4:中國自主生產的基于加速器的BNCT裝置
現在,多個臨床AB-BNCT開發項目正在進行中;日本住友重工(SHI)于2009年與京都大學合作,開發了基于回旋加速器的中子源,2012年京都大學啟動了首個利用此設備進行的臨床研究。我國也在2020年8月成功研制了AB-BNCT的實驗裝置。
總 結
BNCT是一種集核物理、化學、生物、醫學等多學科于一體的治療方法。與傳統的放射治療相比,BNCT是一種很有前途的癌癥治療工具,因為它對腫瘤的輻射高度集中,不會損傷正常組織。經過數十年的發展,BNCT已取得了長足進步。然而,該技術尚處于處于起步階段。需開展更大規模的隨機對照臨床研究以評估BNCT的安全性和有效性。并與其他放療方式進行對照研究。希望在不久的將來,BNCT可成為腫瘤治療領域的一大突破。
敬請注意:本文僅供相關專業人員學習參考之用,文中的所有信息均不作為診斷和治療疾病的依據。如出現文中描述的癥狀,請及時就醫。另外,本文僅節選原文的一部分,內容可能不完整或與原文存在偏差,若需更完整的信息請參閱原文。


