日前,國際離子治療聯合會(PTCOG)乳腺癌小組委員會發布共識聲明。評估了放射腫瘤學領域關于質子治療乳腺癌的可用數據,提出了關于適應證和技術的專家共識建議,并強調了正在進行的臨床試驗的成本效益分析和未來研究的關鍵領域。第一期與大家分享了《乳腺癌質子治療共識聲明(一):理論基礎—危及器官的劑量學優勢》,本期為大家帶來治療計劃的考慮:降低不確定性。原文發表于紅皮雜志International Journal of Radiation Oncology Biology Physics上。

治療計劃考慮:降低不確定性
靶區
建議: 由于劑量梯度的陡峭性,精細、循證的CTV勾畫在質子治療計劃中非常重要(LE 5, D級)。
由于質子布拉格峰劑量的急劇下降,所以精確的CTV勾畫在質子治療中非常重要。例如,盡管RTOG乳腺癌圖譜不包括鎖骨上窩后外側(即后三角),但傳統光子放療鎖骨上前斜方向射野可向該區域提供相當大的出射劑量。由于光子穿過組織時緩慢衰減,進入后三角的出射劑量通常能達到預期控制顯微疾病處的劑量。研究表明,后三角區是鎖骨上淋巴結轉移的常見部位,約有一半的鎖骨上淋巴結位于RTOG CTV的后方和橫向邊緣。因此,如RADCOMP試驗圖集(RTOG3510)所定義的,對于具有區域淋巴結放療(RNI)適應證的患者,應考慮在該區域勾畫更廣泛的靶區。相反,食管旁和氣管旁淋巴結是乳腺癌淋巴結轉移的罕見部位。在臨床無淋巴結累及的情況下,CTV內側邊界不應延伸至頸內靜脈內側,計劃優化時應限制食管的劑量,以降低發生食管炎和繼發性食管癌的風險。對于初始分期檢查中肉眼可見的淋巴結腫大的病例,將PET圖像或CT圖像與CT模擬圖像進行融合,以確保CTV包括高危淋巴結區域。對于胸壁CTV,在無直接臨床侵犯的情況下,后邊界不應延伸至肋間肌或肋骨,這樣可使劑量在心臟和肺前迅速下降,并減少對肋骨的照射劑量(圖2A~2C)。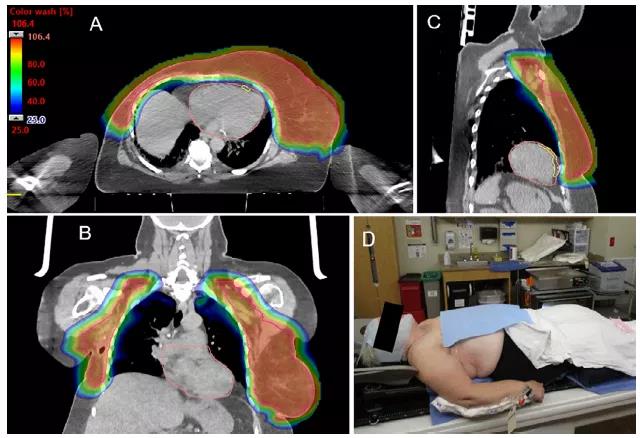
隨著乳腺癌術后放療(PMRT)靶區勾畫指南的發展,與光子放療相比,質子治療可能會進一步減少對正常組織的照射劑量。例如,ESTRO最近修訂了PMRT關于乳腺再造部分的靶區勾畫共識指南。指南中,對于接受PMRT的患者,胸壁CTV僅限于植入物腹側的皮下組織和胸大肌,在無“不利因素”的情況下排除植入物后的組織。若此種方法的安全性最終得到前瞻性確認,質子治療將是將劑量遞送至這些較小體積靶區的理想選擇,從而進一步減少對心臟、肺和肋骨的照射。然而,胸大肌內和后側復發的情況也已經被報道,可能是臨床隱匿型。此外,這一區域在PMRT試驗中已被常規治療,即使CTV沒有明確勾畫,光子放療計劃中也至少部分覆蓋了這一區域。最后,這種技術還沒有被用于越來越普遍的胸前植入物重建的測試。因此,在現有數據的基礎上,質子治療中胸壁CTV應考慮納入植入物最后方的范圍和緊靠肋間肌和肋骨前的組織。
LET和RBE非均勻性
建議: 臨床前和臨床證據表明,用于腫瘤控制和毒性的質子RBE在射程末端會增加。在制定治療計劃時應注意這些潛在的影響(LE 4, C級)。
在臨床實踐中,常規使用固定的質子RBE值1.1;然而,RBE在布拉格峰和遠端下降處要大于1.1,并且遠端下降處質子束的LET值最大。典型的乳腺或胸壁RNI計劃中,質子束遠端邊緣位于肋骨和肋間,鄰近重要組織心臟和肺。當假定質子RBE轉換的物理劑量不變時,較高的LET可導致更大的RBE。事實上,麻省總醫院(MGH)的研究小組已經報告了晚期肺影像學改變及肋骨骨折方面的臨床數據,顯示RBE大于1.1。在Mayo Clinic,乳腺、胸壁和IMN CTV最后方的幾毫米區域可以接受90%至95%的物理處方劑量,因為這些區域的LET較高,預計生物效應作用范圍將擴大到這些區域。計劃通常使用2~3個射野,以限制潛在的生物學熱點和生物學效應范圍擴展至肋骨、胸壁、心臟和肺。此外,為了降低因RBE不均勻性導致的晚期臂叢疾病風險,還需對臂叢進行劑量限制。質子治療計劃和遞送方面的進展,如LET/RBE優化、可變RBE建模和點掃描質子弧形照射,可進一步緩解LET/RBE不均勻性對正常組織的潛在影響。
射程不確定性
對于所有的質子治療計劃,射程不確定性的潛在影響必須考慮,通常用質子入射射程的百分比來量化。典型乳腺CTV所需射程相對較淺,大多數乳腺治療橫貫的組織由脂肪、肌肉或腺組織組成,其射程計算的不確定性相對較低。因此,綜合遠端外擴約2~3 mm用于生成魯棒性質子計劃,使對心臟和肺精準保護成為可能。
自適應再計劃
建議: 臨床檢查、體表成像和體積成像可識別影響劑量分布導致重新計劃的解剖學變化(LE 4, C級)。
可靠的組織定位對于保證質子束路徑長度的一致性至關重要。質子束的正面方向布野與有限的質子射程相結合,使沿胸壁界面的劑量分布對路徑長度的變化非常敏感。例如,乳腺或胸壁的收縮(如血清瘤的消退)會減少質子路徑的長度,從而增加對肺和心臟的劑量。相反,治療引起的腫脹可在靶區最深處沿胸壁或IMN CTV形成一層欠量區。體表成像可識別治療期間的解剖學變化,并已被用于治療期間的跟蹤。此外,可以考慮對治療計劃進行周期性的體積成像評估,以量化質子治療過程中解剖學變化的影響。在組織變化導致計劃魯棒性破壞的情況下,可以考慮自適應計劃。通過模擬潛在治療期間的解剖學變化,使用魯棒性治療計劃減少再計劃的需要。因此,除患者特定因素,自適應再計劃的需求可能隨治療機構使用的計劃參數和原計劃的魯棒性而變化。在一項研究中,接受PMRT重建的患者有10%進行了再計劃,以改善CTV靶區覆蓋或/和均勻性。然而,在該機構進行乳腺癌部分乳腺加速照射(APBI)時,驗證掃描的時間≤1%,由于治療時發現與模擬相比無明顯組織變化,因此驗證掃描被放棄。
部分乳腺照射計劃的考慮
APBI已實現俯臥位和仰臥位手臂上或下位擺位的可重復性。許多用于質子APBI治療的初始技術包括使用固定擴展布拉格峰(SOBP)的3~4個射野、準直孔徑和基于補償器的雙散射技術。根據乳腺內的靶區位置,使用這些技術時為了避免皮膚劑量重疊的情況必須在治療野之間使用較大的角度間隔。這些更切向的射野可降低皮膚劑量,但可用低劑量治療更大體積的乳腺組織,它們對準直誤差和呼吸運動表現出更大的敏感性。
筆形束掃描(PBS)的實施為APBI提供了對質子束射野的點對點強度控制。這種增加的自由度可用于優化近端適形性,并且在射野存在重疊的情況下,也能提供皮膚劑量保護。此外,與雙散射質子治療相比,先進的束斑優化方法(如多野優化[MFO])可用于提高總體計劃對擺位和射程不確定性的魯棒性,并進一步減少危及器官劑量。
乳腺、胸壁和RNI計劃考慮
為了避免周圍正常組織的過量劑量,最常用的是正向射野;正向射野可遠端保護心臟和肺及允許呼吸運動方向上的束流路徑。在這種情況下,布拉格峰的遠端劑量衰減被定位在肋骨、肋間隙和IMNs中,可充分利用質子束的遠端劑量急劇衰減優勢。區域淋巴,包括腋窩淋巴結和鎖骨上淋巴結,也可用正向射野治療。對于雙散射質子治療,處理區域的大小通常需要多個匹配射野和匹配線的變化。傳統的皮膚表面匹配線的臨床驗證方法在典型的質子治療遞送系統中存在困難。PBS遞送提供的束斑強度控制可使遞送不需要準直器。PBS射野邊緣設計成緩慢的梯度劑量衰減從而使其對擺位誤差變得不敏感,這對治療大的靶區尤其有利,如雙側乳腺癌(圖2)。此外,PBS整個射野可做到像光子一樣保護皮膚劑量(圖3和圖4)。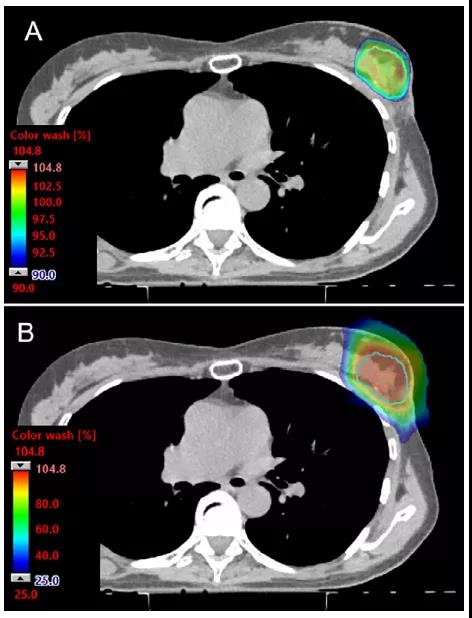
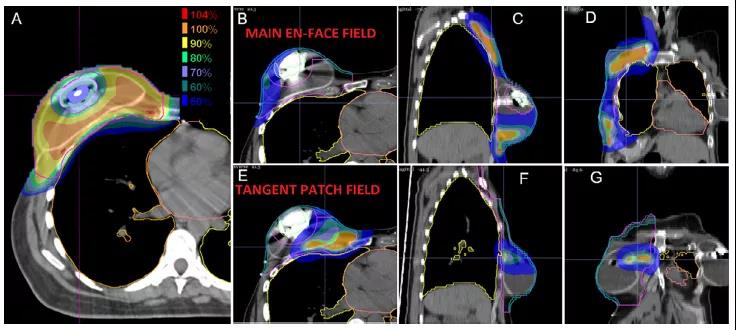
靶區劑量被優化給整個靶區提供均勻劑量(如單野均勻劑量)的計劃中,最大程度的保護乳腺和胸壁區域的皮膚依賴于貫穿整個靶區的調制,因此想用更少的體表保護就需要大的調節。這種情況下,最大程度的皮膚保護將導致整個射野形成不均勻的分布。通過使用多個射野進行治療,而且不要求每個射野的劑量均勻(即MFO),這些組合射野可一起優化,以實現更優的計劃方案及更均勻的皮膚保護。鑒于乳腺癌質子治療的顯著差異,在評估和解釋質子治療結果時關注所使用的技術(即PBS與雙散射)是至關重要的。
組織擴張器通常在乳腺切除術時放置,作為第二階段乳腺重建的一部分。這些擴張器包含由高原子序數材料制成的金屬端口,在CT計劃圖像上會產生相當大的偽影,提高了準確預測通過端口及其周圍的阻止本領的復雜性。為應對這一挑戰,減少金屬偽影算法、圍繞端口周圍進行治療的MFO技術(圖4)、仔細的端口特征描述并使用蒙特卡羅方法來提高劑量計算的準確性的計劃被實施,從而實現通過端口進行治療。由此產生的質子計劃比光子計劃具有更加優越的劑量學特性。
深吸氣屏氣(DIBH)在光子計劃中通過使心臟和冠狀動脈遠離束流以減少心臟劑量,目前已被證明是一種有效的方法。在一些乳腺癌質子治療患者中,DIBH也可促使心臟結構向遠離IMN CTV和高LET區域的下方和后方移動。然而,常規使用DIBH來減少未經篩選的患者的心臟劑量似乎并沒有益處。DIBH過程造成的心臟物理位移通常被低密度肺組織所取代。由于乳腺癌質子治療使用正向射野,它導致通往心臟的水當量路徑長度變化極小,通常在無顯著心臟位移的情況下,對心臟的額外保護很少。對于光子切線野,呼吸運動使靶區的深度邊緣在高劑量區域內外振蕩。質子遞送中使用正向野,質子路徑通常是呼吸運動的方向。雖然這些組織作為呼吸周期的一部分在移動,但從皮膚到靶區遠端邊緣的質子路徑長度并不隨呼吸運動而發生顯著變化。因此,相對于束流射程和擺位的不確定性而言,典型的呼吸模式并不是治療期間不確定性的主要來源,常規治療計劃過程中應對束流射程和擺位的不確定性加以考慮。