臨床超過60%的癌癥患者都會接受放療。被譽為未來放療技術的超高劑量率輻照(FLASH-RT)近兩年來引起了學界業界的巨大關注。與傳統劑量率輻照(~1 Gy/min)相比,FLASH-RT(> 40 Gy/s)被認為在保證腫瘤殺傷的情況下可以大大降低對正常組織的損傷,顯著提升放療的治療指數,實現對腫瘤更好的控制。
北京大學激光加速器利用激光驅動的離子束具有納秒級的超短脈沖持續時間,使得10^9 Gy/s的超高劑量率輻照成為了可能,為研究極端條件超高劑量率輻照的體內和體外生物學效應提供了新的解決方案。當前國際上關于FLASH的研究較少,尤其是高達10^9 Gy/s的超高劑量率輻照效應研究寥寥無幾,對正常細胞、癌細胞和癌干細胞殺傷效應的基礎過程及其具體機制尚不清楚。
北京大學楊根課題組與馬文君、顏學慶課題組合作,率先在國際上研究了超高劑量率FLASH輻照對正常細胞、癌干細胞和普通癌細胞的殺傷能力。2021年4月,研究結果以題為“Association of cancer stem cellradio-resistance under ultra-high dose rate FLASH irradiation withlysosome-mediated autophagy”(doi:10.3389/fcell.2021.672693)以及題為“Ultra-high dose rate FLASH irradiation induced radio-resistance of normal fibroblast cells can be enhanced by hypoxia and mitochondrial dysfunction resulting from loss of cytochrome c”(doi: 10.3389/fcell.2021.672929)連續發表在Frontiers in Cell and Developmental Biology上。兩篇文章定量和定性探討了在高達10^9 Gy/s劑量率下,單次和多次臨床類似放療劑量輻照后,細胞的凋亡,壞死和焦亡等效應的變化趨勢。文章的主要結果表明:即使在10^9 Gy/s超高劑量率FLASH條件下,癌干細胞相比于正常癌細胞仍然具有顯著高的輻照抗性,且可能與溶酶體介導的自噬水平增加有關;對于正常細胞的殺傷研究表明,FLASH輻照方式下正常細胞輻射抗性增強與細胞氧分壓水平有顯著地正相關。審稿人認為,這兩項研究首次報道了在10^9 Gy/s FLASH輻照下正常細胞、癌干細胞和普通癌細胞的死亡方式和相關機制,為未來的臨床FLASH治療計劃優化提供了參考。
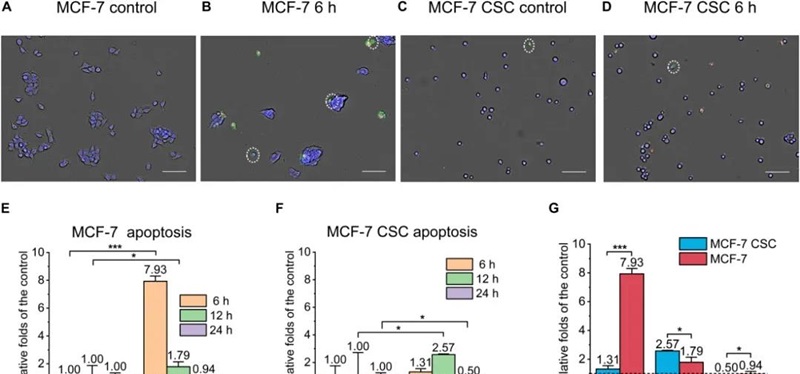
圖1、FLASH輻照后人乳腺癌干細胞和普通乳腺癌細胞的凋亡水平比較
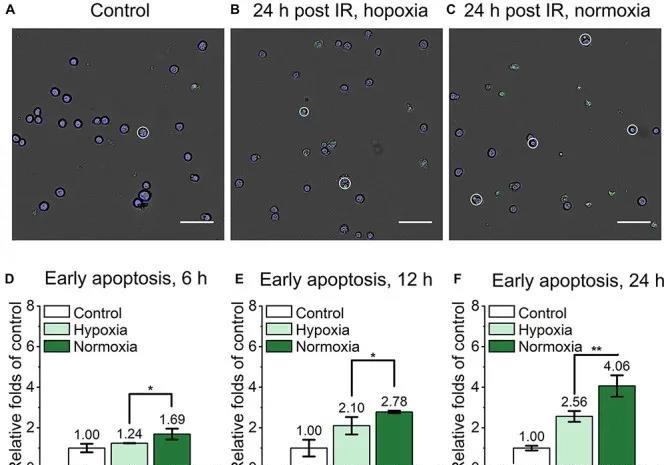
圖2、乏氧和常氧下小鼠胚胎成纖維細胞FLASH輻照后的早期凋亡水平比較
楊根課題組近年來一直圍繞癌癥診斷和治療的核心科學問題持續進行研究。除上述工作外,還探討了癌干細胞(Cancer Science 111: 467-476, 2020;封面)、細胞外環境(Biotechnic & Histochemistry 95: 605-612, 2020;Biomedical Microdevices 22: 40-47, 2020)和細胞內染色質結構(Science China Life Sciences 63: 825-834, 2020)在癌癥轉移等過程中的關鍵作用;設計和開發了系列用于癌癥早篩和治療的微流控芯片(Lab on Chip 20: 4094-4105, 2020),應邀總結和展望了基于CTC的新型POC癌癥診斷策略(Sensors 20, 6073, 2020);針對間皮素陽性的實體瘤(胰腺癌、間皮癌、卵巢癌、肺腺癌和三陰性乳腺癌),開發了基于抗體和放射性alpha核素At-211的特異性治療偶聯物(Journal of Radiation Research 61: 684-690, 2020)和基于正電子核素Cu-64/I-124的特異性顯像探針(Molecular Pharmaceutics 17, 1875-1883, 2020,封面文章)。
這些工作獲得了國家重大研發計劃、國家自然科學基金創新群體項目、重點項目、面上項目、北京市卓青項目、核物理與核技術國家重點實驗室開放課題和北京激光加速創新中心開放課題的資助和支持。歡迎學界和業界的老師們朋友們交流、合作和加入我們(gen.yang@pku.edu.cn;http://www.wiucas.ac.cn/recruitment/oyqyg/2021/793.html)!

