
圖1:68Ga-NODAGA-SNA006論文截圖
v 免疫治療的探索之路
近年來,免疫治療方興未艾,目前已上市的免疫檢查點抑制劑適應癥已覆蓋超過20個瘤種。據估計,只有平均25%的實體瘤患者和40-60%的淋巴瘤患者對當前的抗PD(L)1治療有反應。出現這一結果的主要原因是“適應性免疫抵抗”(AIR),所以對于AIR的研究至關重要。當前,免疫治療已經進入了2.0的新時代,未來免疫治療領域正在向著更加精準的方向發展,我們需要精準的篩選出優勢人群,預測免疫治療的療效和預后。2022年6月14日,陳列平教授在Nature Reviews Drug Discovery雜志上發表了一篇文章,文章基于腫瘤免疫微環境(TIME)提出了4種不同的類型,以更好地定義免疫狀態,預測腫瘤對抗PD(L)1治療的應答反應或耐藥性。
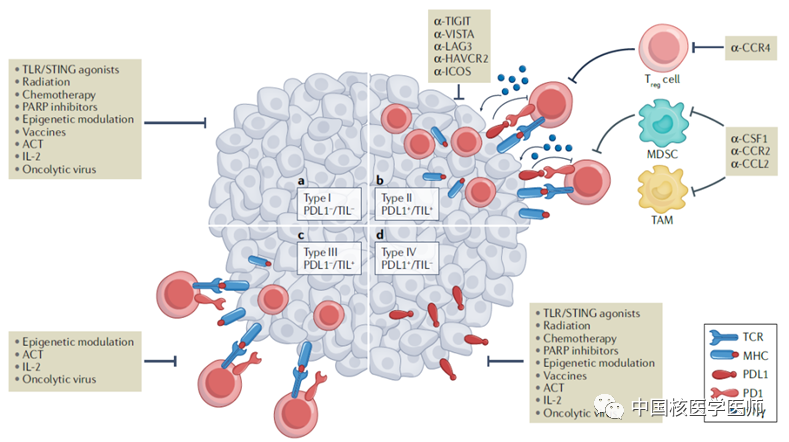
圖2 四種不同的腫瘤免疫微環境(TIME):I型:PDL1(−)/TIL(−),II型:PDL1(+)/TIL(+),III型:PDL1(−)/TIL(+),IV型:PDL1(+)/TIL(−)。
如圖所示,若既有PDL1表達又有T細胞浸潤,則為對PD(L)1治療有應答的II型腫瘤。然而,腫瘤浸潤淋巴細胞(TILs)尤其是CD8+ T細胞,還未被用作預測生物標志物來選擇患者。比如IV型腫瘤不存在T細胞浸潤,抗PD(L)1治療也不會產生反應,所以抗PD(L)1治療的最初耐藥不能僅根據PDL1陽性與否來確定,將CD8+ T細胞用作預測生物標志物來選擇患者更為重要。腫瘤內PDL1+或CD8+的表達水平具有時空異質性且易受治療影響。傳統臨床檢測方式為免疫組化,但因局部取樣方式和治療過程等因素,不能全面、精準的反映PDL1+/CD8+T細胞的水平。使用放射性核素標記單域抗體進行體內成像,可避免多次穿刺活檢,且能夠實時、動態監測全身和腫瘤組織內PDL1+/CD8+T細胞數量的變化,或是未來精準檢測的新方法。此外,該檢測方式具有明顯的臨床價值:
1.作為藥效指標用在藥物臨床開發過程中篩選病人,增加藥物上市的成功率。
2.上市后為臨床醫生制定治療方案提供依據,預測患者能否在免疫治療中真正獲益。
3. 識別免疫不良反應(irAE)。
國際上關于CD8分子顯影劑研究火爆,如美國ImaginAb公司的89Zr crefmirlimab berdoxam產品--89Zr標記minibody靶向CD8+T細胞的分子顯影劑,在完成Phase I后就與國際多個腫瘤免疫公司和放射性藥物公司達成多項合作,涉及領域包括腫瘤疫苗、免疫激動劑、細胞治療等。蘇州智核生物開發的68Ga標記單域抗體相比于ImaginAb的89Zr標記minibody更具有優勢,如下圖所示:
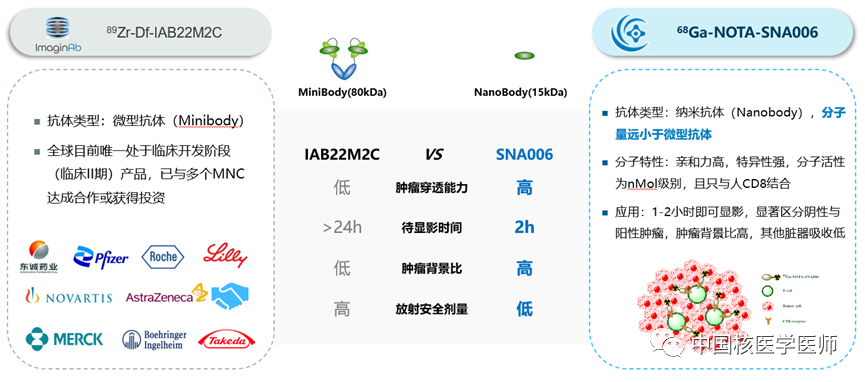
圖3 68Ga標記單域抗體與89Zr標記minibody對比圖
v 68Ga-NODAGA-SNA006試驗數據
蘇州智核生物依托單域抗體技術搭建了一系列放射性核素診療藥物。診斷領域中有首個獲得中美IND批準的靶向PD-L1的顯影劑(SNA002),之后又研發出另一重磅產品,68Ga標記單域抗體靶向CD8+T細胞的顯影劑(SNA006)。為了加快科研成果轉化速度,智核生物與蘇州大學附屬第一醫院建立了蘇州大學-智核生物放射性藥物協同創新中心。研發團隊針對SNA006成功的開展了臨床前到臨床的轉化試驗,評估了SNA006在嚙齒動物腫瘤模型、靈長類動物和肺癌受試者中的首次人體PET/CT顯像試驗。

圖4 臨床轉化研究中,使用68Ga標記單域抗體的顯影劑對全身CD8+T細胞進行動態定量監測示意圖
試驗內容及結果如下:
1)注射SNA006 1-2小時后快速顯像
6只異種移植MC38-CD8(−)(左側)和MC38-CD8(+)(右側)的小鼠(見圖5),經尾靜脈注射2.28±0.07 MBq的SNA006,并進行動態PET成像。結果如圖5a所示,SNA006靜脈注射后在MC38-CD8(+)腫瘤中迅速積累,而在MC38-CD8(−)腫瘤中幾乎不可見。隨著時間增加,MC38-CD8+/MC38-CD8−腫瘤的攝取量比例逐漸增加。從1小時為9.31±0.27,4小時為42.19±21.54(圖5b)。

2)SNA006具有高的探針靈敏度和IHC的相關性
圖6a顯示了SNA006在接種不同比例的MC38-CD8+細胞的腫瘤模型的成像效果,總體趨勢是腫瘤中MC38-CD8+的細胞比例越高,腫瘤對SNA006的攝取越明顯。進一步的分析顯示,SNA006的腫瘤攝取量與腫瘤內CD8表達的平均密度之間存在定量的線性關系(R2=0.9668,P<0.0001)。

3) 有效的靶向性和高度的特異性
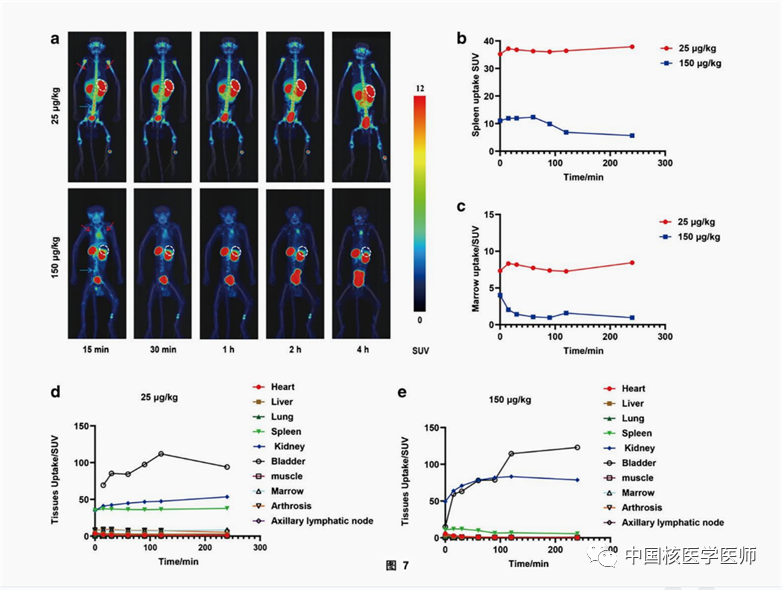
兩只食蟹猴均注射了45-55 MBq的SNA006后,其中一只注射25 μg/kg的SNA006,另外一只注射150μg/kg的SNA006,給藥后立即進行PET/CT成像。結果顯示(圖7),SNA006主要保留在CD8豐富的組織中,如脾臟、骨髓和淋巴結,而在CD8貧乏的組織中,如大腦、肺部和肌肉,放射性攝取較低。當SNA006劑量從25μg/kg增加到150μg/kg時,脾臟的濃度減少了90%以上,這說明SNA006在體內可以特異性靶向CD8,且結合能力較佳。
4)首次人體試驗數據:安全,高質量顯像
在PET成像過程中或注射SNA006后的一周內,受試者沒有出現相關不良事件。脾臟顯示出最高的放射性積聚,這與臨床前結果一致。第三位受試者腫瘤病灶最大,SNA006PET成像有明顯的異質性。IHC染色也證實了CD8在腫瘤病變和癌旁組織中的表達的不均一性(如圖8 d-i),這表明SNA006 PET成像對于量化CD8的表達具有很高的敏感性。

展望
在全球腫瘤免疫治療火熱的大背景下,有越來越多的循證證據表明CD8+T細胞是預測患者對免疫治療應答反應重要的生物標志物。更為重要的是,由于CD8+T細胞的表達異質性特點及臨床實際中需多次穿刺活檢取樣的痛點問題,這種無創式的放射性核素顯影劑的臨床意義變得愈發重要,更能滿足臨床患者真正需求。此外,CD8+T細胞顯影劑可應用的領域如下圖所示:

近兩年,國內核藥企業研發投入增長強勁,核藥賽道受到越來越多的臨床核醫學專家及腫瘤免疫專家的關注。此項研究數據的發布預示著未來會有更多臨床專家和藥企進行合作探索。有專家表示:免疫治療已逐漸成為繼化療、靶向治療后更加主流的治療方式,傳統免疫組化方式雖為金標準,但弊端明顯,如有創取樣、僅檢測局部腫瘤組織等問題,亟需能夠解決上述問題的新型檢測手段。上述數據的公布給予了臨床一定的數據參考,初步顯示了PET/CT顯影方式的臨床可行性,相信未來會有更多的臨床專家進行更加深入的探索。此外,我們非常期待該產品能夠盡快推至臨床I-III期試驗,造福更多的患者。

關于蘇州大學-智核生物放射性藥物協同創新中心
蘇州大學—智核生物放射性藥物協同創新中心于2020年成立,依托蘇州大學以及蘇州大學附屬第一醫院臨床藥學團隊和核醫學科。蘇州大學附屬第一醫院臨床藥學團隊在繆麗燕教授帶領下,深入開展創新藥臨床研究與轉化,在臨床試驗中融入藥物基因組學、PK/PD建模等技術,并率先在國內應用同位素14C標記小分子藥物,開展新藥物質平衡研究,以及正電子核素(68Ga、89Zr、18F等)/單光子核素(125I、131I、177Lu等)標記放射性藥物的分子影像研究,依托“十三五”國家新藥創制重大專項支持,目前已建成了以同位素示蹤為特色技術的新藥創制研究與轉化平臺,為新藥高效研發提供有力的臨床支持。協同創新中心作為校企間重要的科技創新平臺,旨在加快科研成果轉化速度,提升產業科技創新水平,致力于放射性同位素標記單域抗體的分子影像研究,為腫瘤診斷和治療提供精準解決方案。
關于SNA006
SNA006為智核生物自主研發的以68Ga標記單域抗體靶向CD8+T細胞的顯影劑,也是國內首個獲得臨床數據的放射性核素顯影劑。SNA006只與人T細胞的CD8受體特異性結合,1-2小時即可獲得全身靶病灶內CD8+ T細胞的正電子發射斷層掃描(PET)成像結果。SNA006結合PET/CT是打破傳統有創式的免疫組化方式監測CD8+T細胞的創新型診斷方法。目前蘇州大學附屬第一醫院繆麗燕團隊發起的IIT試驗已完成。相關研究發表在多篇高質量、高影響因子的學術期刊J Nanobiotechnol和EJNMMI上。
關于智核生物
蘇州智核生物成立于2015年,是一家以“用最具創新性的核醫學診療產品,給患者帶新的希望”為使命的核醫藥公司,致力于為全球患者提供創新性的放射性核素診療藥物。智核生物創建了具有自主知識產權的基于單域抗體的放射性藥物發現、研發、生產技術平臺,并建設了近萬平的抗體偶聯放射性藥物GMP車間(乙級資質)。公司前瞻性的布局了一系列專業化、高質量的放射性藥物研發管線,涵蓋10多個創新核素診斷和治療產品。首個針對甲狀腺癌放射性碘治療的重組人促甲狀腺激素(SNA001)已遞交新藥上市申請并獲得受理,將填補中國大陸用藥空白;多個創新的針對腫瘤的放射性顯影藥物已經逐步進入臨床,其中首個自主研發的靶向PD-L1的放射性核素標記的顯影劑(SNA002)已獲得中美臨床試驗申請批準。