本期我們為大家帶來質子治療的PET/CT驗證顯像。
質子重離子束在人體內具有特殊的深度劑量分布 — 布拉格峰,使得質子重離子束可以近乎理想地實現腫瘤部位的“定點爆破”,對周圍正常組織的照射可降到最低。
由于質子重離子束特有的物理和生物學優勢,已在全球迅速推廣。迄今為止,已有90多個質子重離子治療中心投入運行,其中大部分為質子治療中心,并且大約同樣數量的治療中心正在建設或規劃中。
在過去的幾十年中,加速器技術、束流傳輸和醫學物理學取得了長足的發展,可優化對復雜形狀腫瘤區域的劑量傳遞,并更好地保護周圍的正常組織和關鍵器官。
然而,在臨床上充分利用質子重離子束的優勢仍面臨挑戰,尤其是在治療過程中束流在患者體內射程的不確定性。盡管目前的成像技術可在每個分次治療前提供SPR(阻止本領比值)估算的容積模型,但臨床中依然希望監測并記錄實際的治療情況,以便及時干預出現的誤差或在后續分次治療中進行補償,因此在這一多學科領域的研究迅速崛起。
2020年德國慕尼黑大學Katia Parodi教授在《British Journal of Radiology》雜志上撰文回顧了質子治療體內成像最新技術進展與臨床應用,其中包括體內質子束射程(劑量)驗證與PET顯像。從上世紀60年代末的早期研究[1-3]開始, PET仍然是臨床上唯一可用的三維、無創、體內監測質子重離子治療的方法,尤其是監測質子重離子束的射程與范圍。
入射質子重離子與人體組織間的相互反應可產生正電子(β+)活化元素(如半衰期為2-20分鐘的15O和11C),正電子湮滅輻射產生的511Kev的ϒ射線能進行PET成像。近年來多家治療中心針對質子治療的PET驗證進行了模型和人體研究,盡管依然面臨挑戰,但已經體現出PET/CT在此領域的巨大應用前景。
1模型研究
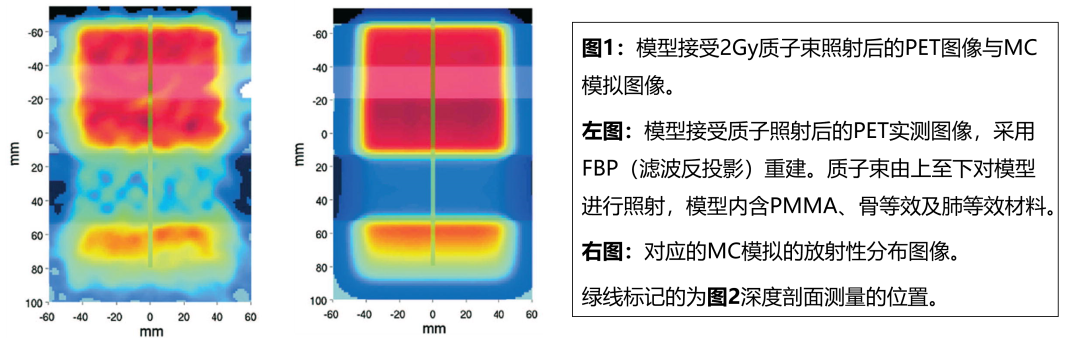
Katia Parodi等[4]采用模型調查了PET/CT用于質子常規治療驗證的可行性,還探討了PET/CT在有金屬植入物存在時的可靠性。研究使用質子束照射不同的模型,這些模型包含聚甲基丙烯酸甲酯(PMMA)、肺與骨等效材料,以及模擬患者植入物的鈦棒。質子束照射后20min內行PET/CT顯像,并通過GEANT4和FLUKA蒙特卡羅(MC)算法,基于CT圖像模擬正電子活化的量和空間分布。
研究表明即使在低治療劑量照射(2Gy)后,質子射程和照射場位置的PET驗證仍具有毫米精度的潛力(圖1與圖2),且PET在有金屬植入物的情況下仍可用于治療驗證。
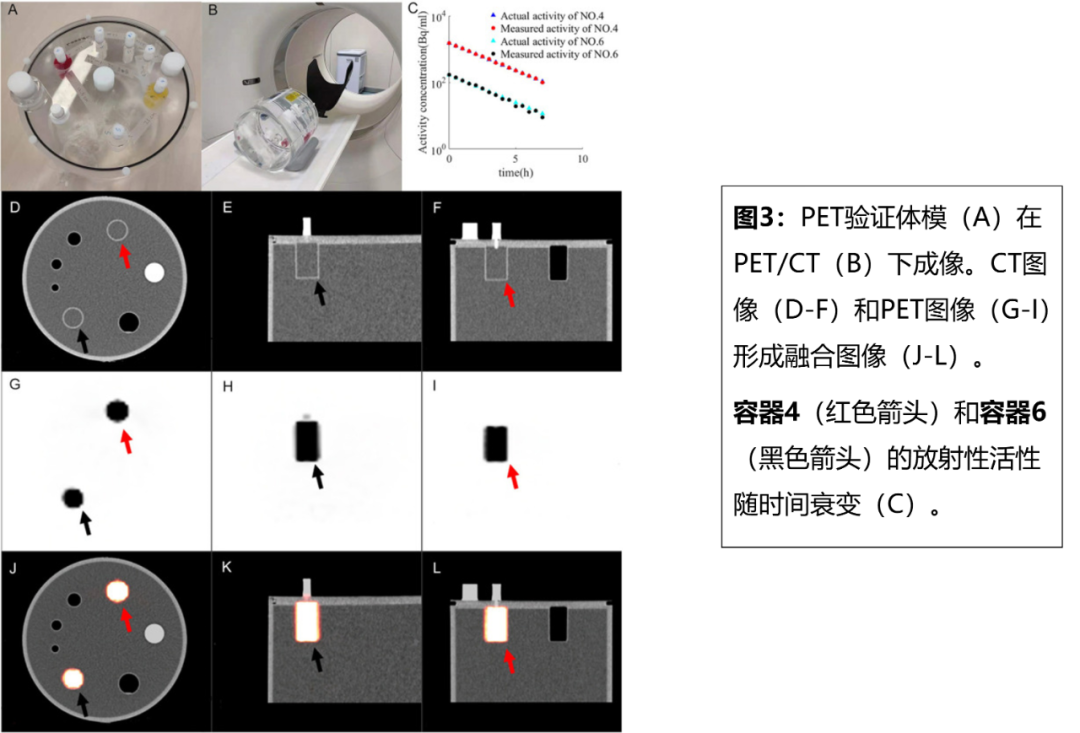
2021年Fuquan Zhang等[5]通過模擬質子重離子束觸發的超低放射性活度,定量分析PET采集的放射性量和空間范圍的準確性。質子重離子束觸發的正電子放射性屬于超低活度(ULA)。因此,為了保證PET臨床驗證的可靠性,需要評估在ULA情況下PET測量的放射性活度和空間范圍的準確性。
PET驗證模型和低放射性18F-FDG用于模擬放射性活度為11.1–1480 Bq/mL的ULA。PET/CT采用SIEMNES Biograph mCT,通過將圖像中的放射性與根據衰變函數計算的實際值進行比較,評估PET對ULA放射性定量的準確性,放射性誤差容限設置為5%。通過比較放射性分布曲線的寬度與容器的實際寬度,評估PET對ULA空間范圍測量的準確性,空間范圍誤差容限設置為4mm(圖3)。
研究表明當ULA的放射性>148 Bq/mL時,放射性誤差<5%;當ULA的放射性>30 Bq/mL時,空間范圍誤差小于4mm,即當質子重離子束觸發的放射性活度>148 Bq/mL時,PET可準確量化其放射性量和范圍。
2體內研究
Chul Hee Min等[6]納入9名接受質子治療的患者,評估同室PET進行治療驗證的可能性,并探索合適的PET掃描時間。所有患者治療后立即使用同室PET進行掃描,測量PET活性邊緣與靶區邊緣的距離,并與蒙特卡羅(MC)預測的范圍進行比較。
PET實測圖像總體上與MC模擬的結果具有良好的空間相關性(圖4),一些差異可能與MC預測模型在局部元素成分和生物洗脫方面的不確定性有關;對于8名接受單場治療的患者,PET實測結果與MC模擬結果之間的平均范圍差異小于5 mm(其中有6名患者小于3 mm)。此外,與20分鐘的PET掃描相比,5分鐘的短PET掃描可以得到類似的效果。

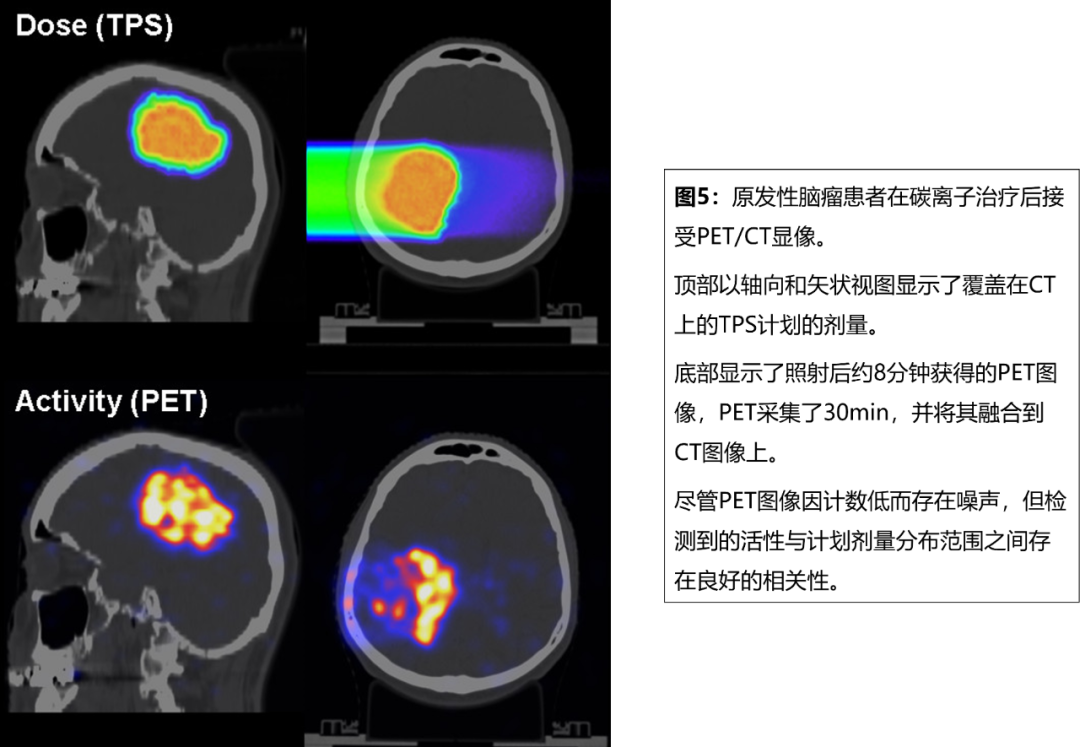
德國海德堡離子束治療中心也開展了PET/CT驗證方面的研究[7],在首例治療后接受PET/CT顯像的患者中發現正電子活性分布范圍與TPS劑量分布范圍有很好的相關性(圖5)。Josefine Handrack等[8]調查了PET/CT對質子分次治療間變化的敏感性。現代質子重離子束治療,為腫瘤高度適形提供了非常銳利的劑量梯度。然而,它對組織阻止特性的不確定性、解剖變化、位置錯誤非常敏感,因此分次治療間射程驗證非常重要。
此研究納入14名不同適應癥的患者在質子束或碳離子束治療后接受PET/CT監測。除了PET/CT實測外,還在CT數據上模擬了PET活性和劑量分布,然后根據束流路徑上的縱向位移對PET數據進行分析。研究發現PET實測和模擬都可以推斷出±3mm的分次治療間的偏移,并且與CT掃描得出的解剖變化有很好的相關性(通常在1.8mm以內)。
3挑戰與機遇
由于質子活化的正電子放射性活度很低(比常規PET成像低幾個數量級),且半衰期較短,通常需要在治療結束后盡快進行PET/CT顯像,以獲取足夠的PET計數、提高信噪比及降低生物洗脫的干擾。此外,PET圖像需與治療計劃CT精準融合,且需具備足夠高的空間分辨率,才能精確驗證質子射程。
在質子放療快速發展的時期,PET/CT在靈敏度、信噪比、空間分辨率、像素分辨率等重要技術領域也取得了長足的進步。西門子多款PET /CT設備曾應用于質子治療后顯像研究,目前全新系列的PET/CT隨著性能全面提升,能夠更加精確地呈現目標區域的形態和邊緣,結合大孔徑與TG66標準的放療成像檢查床,能夠讓PET與治療計劃CT更加精準地配準融合。
PET/CT最新技術突破與先進的質子治療結合,將為此多學科領域的科研和臨床應用帶來巨大的機遇!