結構生物學是以分子生物學,生物化學和生物物理學為基礎的學科,研究對象為生物大分子,如蛋白質和核酸等。目的是利用生物或物理手段來看清楚生物大分子的精細形態,以闡述生物大分子行駛功能的機制,幫助生物學家更好的認識生命活動的過程。而且,很多藥物分子的作用靶點大多為蛋白質,所以結構生物學在藥物研發中起到重要指導作用,為機理研究到藥物開發帶來清晰的認識。
針對生物大分子中的蛋白質的研究,主要的研究手段有:核磁共振(nuclear magnetic resonance,NMR)、X射線晶體學(X-ray crystallography)和冷凍電子顯微鏡(cryo-electron microscope, cryo-EM)。核磁共振主要針對溶液中的、分子量很小(約20kDa)的樣品類型,最近幾年已使用不多。近年來,也出現了一些新技術,微晶電子衍射(MicroED)是一種利用冷凍電鏡解析微小晶體結構的技術,由于電子束與物質的作用遠強于X射線,可以解析X射線晶體學難以處理的納米晶體結構。特別是對于以往難以培養單晶的蛋白樣品來說,MicroED為結構生物學家提供了一個前景廣闊的新工具,彌補現有技術的不足。該技術被《Science》雜志評為2018年十大突破技術之一。
X射線衍射——最富傳統意義的結構解析方式
早在1895 年,倫琴(W. C. Roentgen)就發現了X射線。X射線的發現推動了現代生物學的發展,甚至可以說對整個科學技術領域產生了極為深刻的影響。1912 年,勞厄(M. V. Laue)與弗里德里希(W. Friedrich)以及倫琴的博士研究生克里平(P. Knipping)利用 X 射線對硫酸銅晶體進行衍射實驗,并在底片上得到了一些粗大的、橢圓形的斑點,發現了 X 射線晶體衍射。而后,他們又對 ZnS、 PbS、 NaCl 等晶體進行 X 射線衍射實驗,得到了清晰的四重對稱衍射圖。勞厄還提出了 Laue 方程來描述晶體的 X 射線衍射。ZnS 晶體的 X 射線衍射照片發表不久,布拉格(W. L. Bragg)重復此實驗,并在1913年推導出了 X 射線衍射方程,即著名的布拉格方程。X 射線衍射的發現和勞厄方程以及布拉格方程的建立標志著 X 射線晶體學的誕生。到1957年,X射線晶體學就解析得到了第一個生物大分子——抹香鯨肌紅蛋白的結構。而到現在為止,約有十五萬的生物大分子結構是利用X射線晶體學解析的。X 射線晶體學解析蛋白質三維結構之所以發展如此迅速,主要是因為有以下幾點優勢:1. 能夠達到很高的分辨率,接近原子水平;2. 對蛋白質的大小和成份類型沒有限制,所以無論是分子量超大的多亞基復合物還是分子量很小的多肽,都能通過此方法得到理想結果。但此方法必須有高質量的大尺寸晶體作為前提,所以其第二點優勢同時是其限制所在,得到質量較好的晶體對于分子量巨大或者結構柔性的對象來說往往較為困難。
基于冷凍電子顯微鏡的單顆粒分析技術
近幾十年,冷凍電子顯微鏡發展迅速,在結構生物學領域逐漸發揮出舉足輕重的作用。早在1939年,西門子公司制造了世界上第一臺商業化的電子顯微鏡。為了防止高真空及強烈的電子轟擊對樣品的破壞,人們用重金屬染色或糖包埋的方法處理樣品。但由于都對樣品進行了破壞性處理且都是在常溫條件下進行觀察,所以分辨率都受到了限制。到1984年,J. Dubochet等人發展了冷凍生物樣品的方法并總結了得到玻璃態冰的方法1,2,這是最早的快速冷凍技術(cryo-freezing) 并開啟了“冷凍” 電子顯微鏡時代。通過將生物大分子的溶液樣品快速投入至冷卻到液氮溫度的液態乙烷中,得到冰層厚度合適的冷凍樣品,然后對冰層中均勻分布的生物大分子顆粒進行拍照,得到上千張照片。通過算法對拍到的二維照片進行分析,最終得到其結構,此方法稱之為單顆粒分析技術(single particle analysis)。近些年,隨著直接電子探測相機(direct detection device, DDD)的出現和各種數據處理軟件的發展,冷凍電子顯微鏡解析的生物大分子三維結構所占比例越來越大(見圖1)。比如2020年3月發表在Science雜志的研究通過冷凍電子顯微鏡單顆粒分析技術,確定了與胰高血糖素及不同類別的異源三聚體G蛋白(Gs或Gi1)結合的人源胰高血糖素受體(GCGR)3.7 Å和3.9 Å的結構(見圖2)。該研究的多個結構與藥理學數據相結合,為II型糖尿病和肥胖癥的治療提供了重要見解3。
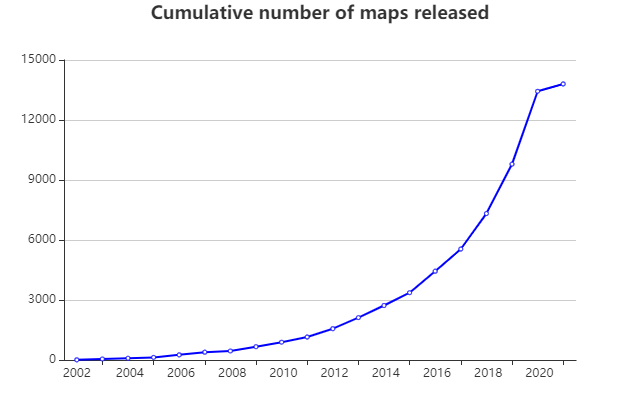 圖 1 冷凍電子顯微鏡解析的生物大分子三維結構數目的變化趨勢
圖 1 冷凍電子顯微鏡解析的生物大分子三維結構數目的變化趨勢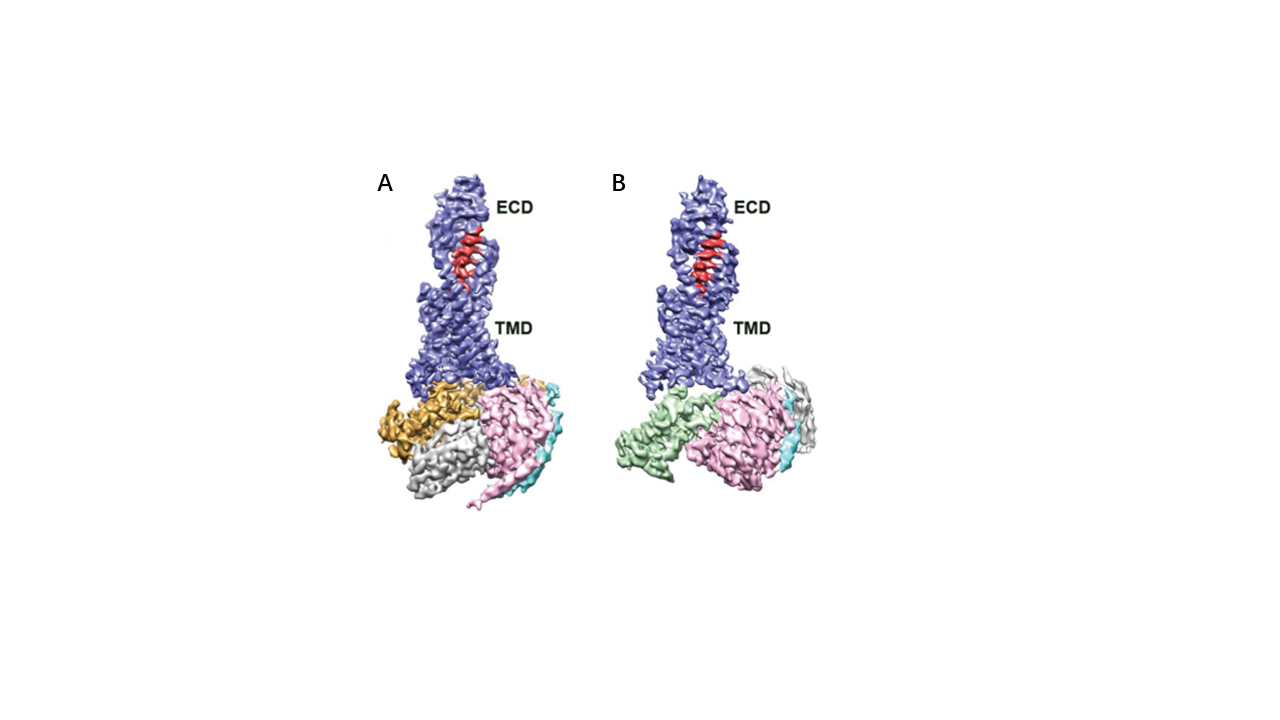
單顆粒分析技術不需要得到晶體且樣品使用量非常少,這使得針對難以結晶的膜蛋白或大分子復合物的研究成為可能。然而,雖然單顆粒分析技術對樣品要求量較低,卻沒有降低對樣品均一性的高要求。而且,雖然隨著探測器和算法的不斷提升,單顆粒分析技術已經能夠得到分辨率2 Å以內的結構4,但仍然是相對個例,其分辨率普遍還是在3 Å左右。不過,人類之所以能創造文明,就在于對神秘自然、科學真相永無止境的探索;而各研究領域的不斷發展推進,勢必會相互影響、相互促進。
MicroED——晶體學與冷凍電子顯微鏡在當代的完美糅合
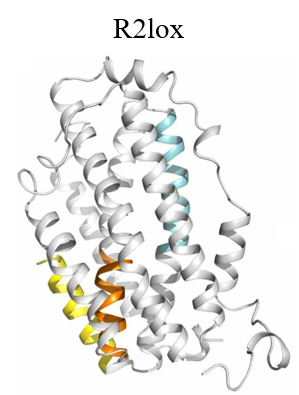
在電子顯微鏡發展初期,X射線晶體學技術正蓬勃發展;此時,也正處于衍射理論和數據處理方法逐漸成熟之時。電子晶體學就是電子顯微鏡技術與晶體學結合的產物。在2007年,斯德哥爾摩大學的科學家聰明地將晶體學和電鏡相結合,用冷凍電鏡去看晶體,發展出了一項重要的新技術——MicroED (Micro electron diffraction)。MicroED主要是通過電子對微小的晶體進行衍射,然后收集電子衍射數據并進行蛋白質結構解析的方法。由于電子的波長短,則受物質散射強(原子對電子的散射能比 X 射線強一萬倍),所以能夠達到的分辨率更高。而且其需要的晶體尺寸非常小,亞微米尺寸的晶體就可以產生足夠高的信噪比衍射信號。這些獨特優勢對于那些能夠得到微小晶體而尺寸無法優化變大的樣品來說,無疑是個好消息。這種技術2018年還被《Science》雜志評為2018年十大技術突破之一。在 MicroED 發展初期,溶菌酶、catalase和 Ca2+-ATPase等模式樣品就被解析到原子分辨率。后來MicroED 進一步發展,不再局限于模式樣品,還解析了α-synuclein中心肽段和R2lox酶6等未知蛋白的結構(見圖3),并且分辨率都高達~1 Å。2016年后,MicroED發展迅速,解析的蛋白質結構的數量也快速增加(見圖4),prions和 FUS LC(fused in sarcoma low-complexity domain)等樣品的晶體結構都得到了1 Å左右的高分辨率(見圖4)。而后MicroED解析的對象難度逐漸增加,甚至還包括了復合物和離子通道等膜蛋白(見圖4)。從2018年開始,人們將MicroED與冷凍聚焦離子束技術(cryo-Focused Ion Beam, cryo-FIB)技術相結合,可以將尺寸稍大但仍不適用與X射線晶體學的晶體剪薄,將適用于MicroED的晶體尺寸范圍擴大至幾十微米,大大拓寬了MicroED技術的應用范圍,填補了MicroED和X射線晶體學之間的空隙。
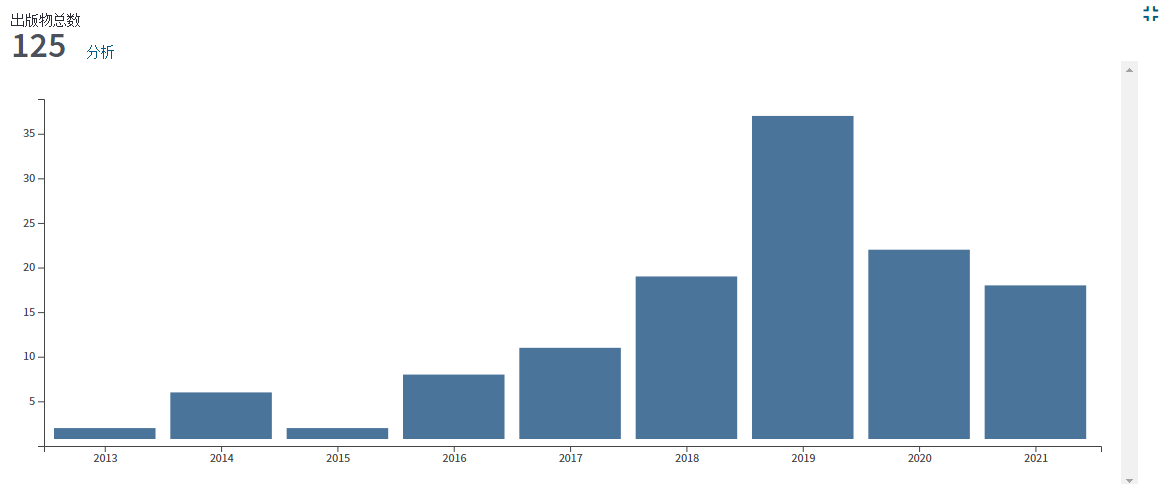
流程簡、分辨率高、時間短——MicroED打開結構生物學探索的新方式
MicroED的原理類似于X射線晶體學。電子波同X射線一樣,照射到類似晶體的樣品上時也能夠發生衍射現象。當中間鏡的物平面位于物鏡的后焦面時,將在熒光屏上得到經中間鏡和投影鏡放大了的電子衍射譜,即為透射電子顯微鏡的衍射模式。在實際的透射電子顯微鏡中,成像模式和衍射模式的中間鏡電流已設置好,通過相應按鈕(Diffraction按鈕)即可實現兩個模式的切換。MicroED對結構生物學領域起到了很好的補充,其工作流程非常簡單且得到結果快速(見圖5)。簡言之,在樣品制備方面,利用X射線晶體學中的蛋白質結晶手段進行結晶,然后用類似單顆粒分析技術的制樣方法進行冷凍制樣,然后收集數據。收集到的衍射數據可以用X射線晶體學的處理軟件進行處理,模型搭建可以用COOT軟件。所以除了一個合適的相機,MicroED可以在任何一臺進行單顆粒分析的電鏡上實現。
由于MicroED的獨特優勢,除了生物大分子之外,其對化學小分子、天然產物、藥物制劑的研究更是再合適不過了。因為化學小分子呈現粉末狀,尺寸上與MicroED的研究范圍非常契合,而且基本可以在幾個小時內從粉末得到其結構信息。很多利用MicroED研究化學小分子的成功案例都驗證了此技術的高效性和應用性(見圖6)。MicroED在生物大分子和小分子藥物上的研究展示了其在結構生物學領域的巨大應用潛力,為結構生物學家提供了一個前景廣闊的新工具。

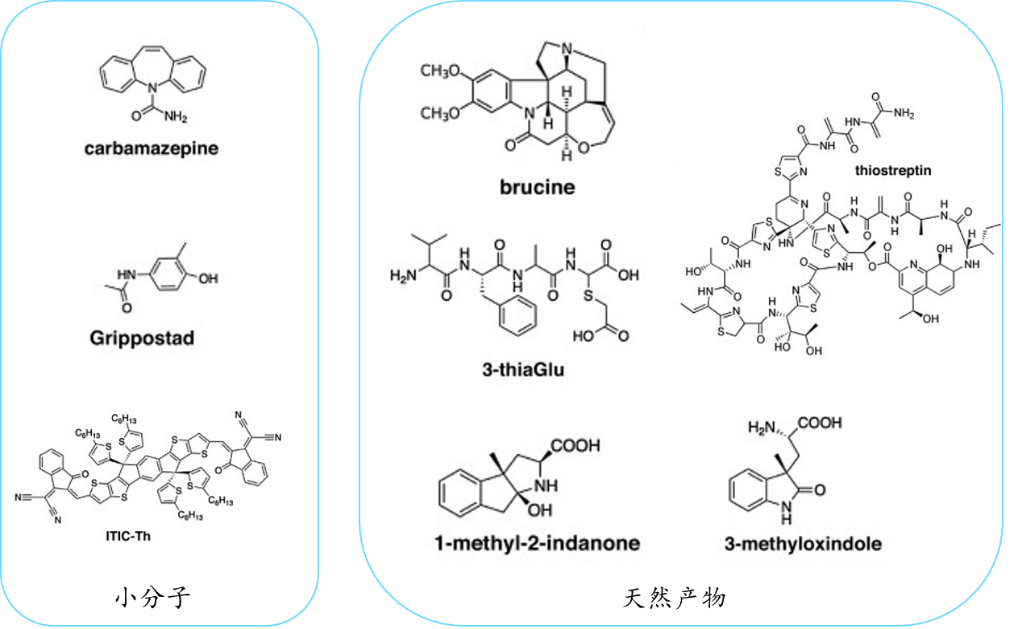
圖 6 MicroED得到的化學小分子及天然產物的案例7
總體說來,無論是X射線晶體學與冷凍電鏡單顆粒技術,還是新興的MicroED技術,都是科學家在不斷嘗試與優化中逐步推進的。它們在技術和研究范圍上相互補充,互相促進,盡最大可能讓人類無窮接近自然真相,繼續引領生命科學的發展。對于商業化的結構生物學測試服務。